-
摘要:
随着聚苯乙烯纳米塑料(PS-NPs)被广泛应用于工业、制药和消费品的包装材料及医疗产品领域,PS-NPs对生物产生的健康效应得到越来越多的关注。因此,从生物学作用机制角度,对体内外实验研究进行文献综述很有必要。本文综合国内外最新研究成果,介绍了PS-NPs在细胞毒性实验中的特性及其细胞内化情况,并总结了PS-NPs对线粒体、溶酶体、蛋白质和DNA等细胞毒性靶点的影响。另外,从理化性质和作用细胞类型这两个方面分析了PS-NPs作用效果的影响因素,讨论当前细胞毒性机制及生物学效应研究热点,为PS-NPs的健康风险防控和生物安全性评估提供参考依据。
Abstract:Polystyrene nanoplastics (PS-NPs) are widely used in industry, pharmaceutical and consumer packaging materials, and medical products. The biological health impacts of PS-NPs are receiving increasing attention. Therefore, it is necessary to conduct a literature review of
in vitro andin vivo experimental studies from a biological mechanism perspective. Based on the latest research results at home and abroad, this review introduced the characteristics and cell internalization of PS-NPs in cytotoxicity experiments, and summarized the effects of PS-NPs on cytotoxic targets such as mitochondria, lysosomes, proteins, and DNA. In addition, the influencing factors of the health effects of PS-NPs were analyzed from the aspects of physical and chemical properties and cell types. Finally, by discussing the current research hotspots of cytotoxicity mechanism and biological effects, it was anticipated to provide a reference for the health risk management and biological safety assessment of PS-NPs.-
Keywords:
- polystyrene nanoplastics /
- cytotoxicity /
- oxidative damage /
- autophagy /
- lysosome
-
塑料已在全球几乎所有陆生和水生生态系统中广泛存在。据统计报道,2019年全球塑料产量接近3.7亿t,中国占世界塑料产量的31%[1]。大量塑料不断被释放到环境中,在各种环境介质中长期存在,并缓慢降解为小于5 mm的微塑料和小于100 nm的纳米塑料。微塑料作为一种快速增长的新型污染物,其毒理学和健康效应已成为国际环境与健康领域的前沿热点之一[2]。其中,聚苯乙烯纳米塑料(polystyrene nanoplastics, PS-NPs)是最常见的类型(38.5%)之一[3],广泛来源于工业生产和日常生活消费产品[4],在其生产和使用过程中可被释放至环境。普通人群接触PS-NPs的机会越来越多,关于其对人类健康影响的相关研究已成为一个新兴领域。本文就PS-NPs的特性、进入人体的途径、对细胞的生物学效应及其机制的研究进展作一综述。
1. PS-NPs的特性及进入人体的途径
PS-NPs是一种由聚苯乙烯纳米粒子以纳米级尺寸(至少有一个维度的结构,尺寸范围在1~100 nm之间)[5]分散在聚合物基体中形成的有机纳米复合材料。PS-NPs主要为球型,具有粒径小、相对比表面积大、疏水性强等特性,在含蛋白质的介质中很容易形成聚集体,易与其他有机物和纳米颗粒产生联合毒性[6-7],且易吸附重金属[8],能较易进入细胞及亚细胞器,具有潜在的人体毒性。
1.1 口服途径
人体可以通过食物、水和空气等暴露途径接触PS-NPs,其中消化道摄入被认为是进入人体的主要途径[7]。通过消化道进入人体的PS-NPs主要源于含有PS-NPs的食物和水,而空气中的PS-NPs也可以通过吞咽动作经消化道进入机体。Cox等[9]根据食品的消费量,估计得出美国每人每年摄入微塑料的量为3.9~5.2×104粒。同时,已有研究在人体粪便中检测出微塑料[10],证实了PS-NPs的消化道摄入。当PS-NPs进入肠道后,在肠道粘蛋白作用下,其表面形成蛋白冠,随后被胃肠道上皮细胞吸收或通过肠道屏障运输,形成再次分布[5]。
1.2 吸入途径
呼吸系统是PS-NPs进入人体的重要途径[11]。据统计,成年男性通过吸入进入机体的微塑料量约为6.2×104粒·年−1,并在人类肺活检中发现了微塑性纤维[10],这表明呼吸器官是空气中PS-NPs毒性作用的主要靶点。进入体内的PS-NPs在呼吸道沉积,通过不同的转移途径和机制扩散至肺外并到达体内的其他靶器官。同时,吸入的PS-NPs还可以透过胎盘屏障从母体转移至胎儿体内并对胎儿的健康产生不利影响[12]。
1.3 皮肤粘膜
目前,在部分日用护肤品中已检测到PS-NPs的存在[13],这可能引起PS-NPs的皮肤暴露。皮肤是人体阻挡外界理化刺激的重要屏障,即使人体皮肤的毛孔孔径小至40~80 μm,PS-NPs也可能通过简单扩散或渗透等形式穿过皮肤角质层进入皮下组织并被人体吸收,并且已有纳米塑料穿过真皮屏障的研究实证[14],但目前仍缺少经皮肤暴露的直接证据。
1.4 注射途径
由于医疗领域对纳米材料的广泛应用,使得注射途径成为其暴露人体的新路径。作为药物或生物分子(如蛋白质、多肽)的纳米载体,PS-NPs可通过临床常用的给药方式直接进入机体[15]。
2. PS-NPs对细胞的生物学效应
2.1 PS-NPs进入细胞的方式
内吞作用是纳米塑料进入细胞的主要方式[16]。Kuhn等[17]的研究表明,直径为40 nm的PS-NPs可通过吞噬作用和网格蛋白介导的内吞作用被巨噬细胞吸收。而在上皮细胞中,PS-NPs可通过网格蛋白或小窝介导的内吞作用和巨胞饮途径进入宿主细胞,并受RhoA/F-actin信号通路调控[18]。除此之外,PS-NPs还可以通过非内吞方式被动进入细胞[19]。进入细胞后的PS-NPs大多会通过无能量渗透和能量依赖性溶酶体胞吐方式或经钙离子依赖性胞吐从细胞中排出[20-21],而未排出的PS-NPs则会积累在细胞中产生相应的细胞毒性。
2.2 PS-NPs与细胞自噬
自噬是介导纳米材料降解的主要分解代谢途径。已有多项研究证实,PS-NPs可以引起细胞自噬的发生[18,22]。相关研究表明,50 nm PS-NPs可促进人神经母细胞瘤细胞自噬,引起自噬标记物轻链3-II和自噬相关蛋白上调[22]。转录因子EB是自噬和溶酶体生物发生的主要调节因子,当PS-NPs被细胞内化后可诱导转录因子EB的活化,激活自噬[23]。而没有通过内吞作用进入细胞的PS-NPs也可以触发自噬,这表明纳米颗粒的细胞质捕获可以通过自噬反应发生[24]。然而,当自噬体的形成受到干扰时,细胞摄取PS-NPs的速度变慢,最终会降低胞内PS-NPs含量[25]。
低水平自噬有助于细胞适应环境,而过度自噬或阻断自噬通量则均发生细胞损伤,成为细胞死亡的诱导剂。研究发现,100 nm PS-NPs被人脐静脉内皮细胞内化后诱导了自噬启动和自噬体形成,并引起自噬通量水平受损[26]。同时,氨基修饰的PS-NPs(amine modified polystyrene, PS-NH2)也能使溶酶体功能失调,溶酶体内自噬通量受阻,并最终造成细胞死亡[27]。这可能是由于纳米颗粒形成的团聚体积聚于细胞内导致自噬通量阻塞[28]。
PS-NPs的表面修饰和电荷在自噬信号传导中同样发挥着至关重要的作用。研究表明,羧基修饰的PS-NPs(carboxyl groups modified polystyrene, PS-COOH)可能通过不依赖雷帕霉素靶蛋白(mamalian target of rapamycin, mTOR)途径引起自噬[29],而蛋白激酶B(protein Kinase B, Akt)/mTOR和单磷酸腺苷活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase, AMPK)信号通路参与调节了PS-NH2诱发的自噬细胞死亡[30]。同时,呈现中性或阴离子表面的PS-NPs可以增强自噬底物的清除,而阳离子表面的PS-NPs会引起溶酶体功能障碍,最终导致自噬通量受阻[23]。
2.3 PS-NPs与细胞凋亡
细胞凋亡是PS-NPs致细胞毒性损伤的病理机制之一。已有相关研究证明,PS-NPs暴露可以降低细胞增殖率并增加细胞凋亡[18]。宫颈癌细胞暴露于PS-NH2后出现细胞缩小、核浓缩、泡状突起和细胞膜塌陷等凋亡迹象,并引起由半胱天冬酶-3/7(Caspase-3/7)激活介导的凋亡[31]。众所周知,Caspase-3激活是细胞凋亡的核心过程。相关研究已表明,Caspase-3/7/9的激活是PS-NPs引起凋亡的主要途径[32]。同时,PS-NPs还可以通过引起促凋亡蛋白、半胱天冬酶-8和细胞色素C表达增加,触发肿瘤坏死因子-α相关的凋亡途径,引起人肺泡II型上皮细胞的凋亡[33]。此外,PS-NPs还可通过诱导细胞氧化损伤和炎症反应,激活p38 MAPK信号通路[34],促进Bcl-2相关X蛋白的过表达[35]和线粒体损伤介导的凋亡机制[32],引起细胞凋亡。
然而,当60 nm PS-NPs作用于肠上皮细胞时,只有带正电荷的PS-NH2能够诱导细胞凋亡,而带负电荷的PS-COOH和未修饰的PS-NPs并不引起细胞凋亡[36]。另一项研究却显示,除PS-NH2外,所有20 nm PS-NPs均能引起人内皮细胞的Caspase-3/7激活,并引起细胞凋亡[37]。出现上述细胞毒性的差异可能是由于PS-NPs的粒径和作用细胞系不同所致。
2.4 其他
细胞焦亡介于凋亡和坏死之间,是由半胱天冬酶-1(Caspase-1)激活的程序性坏死,通常伴有炎症小体激活。研究发现,100 nm PS-NH2可以促进(NOD-like receptor protein 3, NLRP3)炎症小体复合物的组装,并招募和激活Caspase-1,通过切割前促炎性白细胞介素-1β诱导白细胞介素-1的释放,从而引起细胞焦亡[38]。除此之外,PS-NPs还会触发细胞坏死[32,39]。研究发现,表皮生长因子(epidermal growth factor, EGF)会增强PS-NPs的摄取率并通过细胞质中的PS-NPs与EGF复合物共同作用,抑制受体再循环来诱导细胞凋亡,而如果没有EGF,细胞内化的PS-NPs会触发细胞坏死[40]。
3. PS-NPs对细胞产生生物学效应的可能机制
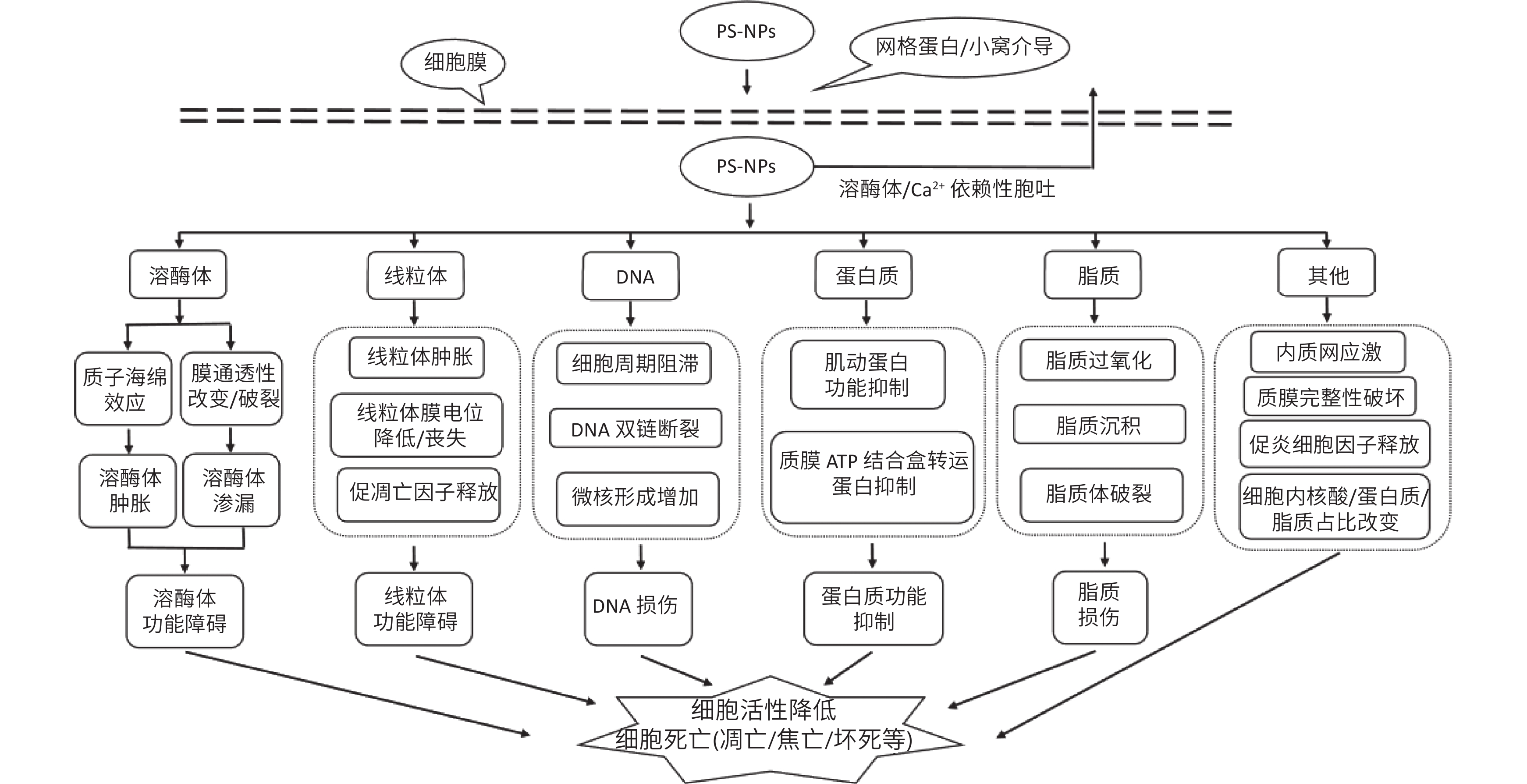
由于PS-NPs易透过生物膜进入细胞内或线粒体、溶酶体等细胞器,并与生物大分子发生结合或催化反应,从而导致激素或酶的活性丧失。目前,基于包括检测细胞存活率、细胞膜完整性及通透性改变、氧化应激等细胞毒性的研究方法,人们发现PS-NPs致细胞毒性的机制主要有以下几个方面(图1)。
3.1 氧化损伤作用
已有多项相关研究证实PS-NPs暴露会使细胞产生大量活性氧(reactive oxygen species, ROS),触发氧化应激反应[14,41]。100 nm PS-NPs可增加脑细胞过氧化氢酶和还原性谷胱甘肽(glutathione, GSH)的活性,而随着暴露剂量的增加,GSH合成与消耗失衡后诱发自身耗竭使脑细胞无法高效清除胞内ROS,从而导致细胞死亡[42]。这说明PS-NPs可以通过结合并消耗细胞内抗氧化物质,破坏细胞内的氧化平衡,造成细胞死亡。
ROS是反映细胞氧化应激的重要指示物,过量的ROS会引发脂质过氧化、蛋白质和DNA等生物大分子损伤,进而造成细胞死亡[43]。PS-NH2 能够诱导细胞ROS产生、GSH消耗和氧化应激[39],而PS-COOH仅产生微量或不产生ROS[44],甚至可以通过触发溶酶体应激来减少ROS[45]。这说明不同表面修饰情况会影响ROS的产量,其中PS-NH2引起的增量最大,其次是未修饰的PS-NPs,而PS-COOH引起的增量最小,甚至不引起。此外,氧化应激还会造成线粒体、溶酶体等细胞器的损伤,这些将在下文中进行详细阐述。
3.2 线粒体损伤
线粒体作为细胞的“能量工厂”,在调节氧化应激、钙离子稳态和凋亡中发挥着重要作用[46]。研究发现,20 nm PS-NPs暴露10 min便可被细胞内化并积聚在线粒体中[47]。被内化的PS-NPs主要通过引起线粒体形态改变(线粒体肿胀)或膜电位降低来损伤线粒体功能[32,48]。据报道,50 nm PS-NH2暴露引起的氧化应激反应会导致线粒体ROS产生,低剂量时线粒体膜电位发生超极化,较高剂量时则发生线粒体膜电位的丧失[49]。而超极化本身也会导致ROS和氧化应激的增加,并最终导致线粒体去极化。这表明PS-NPs引起的氧化应激反应在损伤线粒体的同时,又会因线粒体释放ROS,加重氧化应激。同时,线粒体ROS产量的增加还会导致其他细胞毒性效应和促凋亡因子的释放[50]。研究发现,PS-NPs可以使线粒体膜通透性增加并引起内在凋亡途径的起始物细胞色素C释放增加[51],说明PS-NPs可以激活线粒体凋亡途径[22]。同时,PS-NPs引起的线粒体ROS积累还会使硫氧还蛋白(thioredoxin, Trx)氧化,导致组装炎症小体的细胞质感受器NLRP3结构域构象变化,从而触发NLRP3炎症小体激活,引起细胞焦亡[38]。
3.3 溶酶体损伤
PS-NPs被细胞内化后主要积聚在溶酶体中,并可能引起溶酶体膜通透性改变[20]。部分溶酶体膜通透化会导致ROS生成和细胞死亡,而大量通透化则会诱导细胞溶质酸化和坏死。以往的研究发现,PS-NPs暴露后,溶酶体结构受损,溶酶体膜破裂使溶酶体内容物释放到细胞质中[40]。溶酶体膜对ROS特别敏感,易通过氧化应激发生急性损伤[52],而PS-NPs可诱导细胞生成大量ROS。同时,ROS又会诱导溶酶体渗漏,渗漏的溶酶体蛋白又会促进线粒体产生ROS,从而形成反馈回路,导致溶酶体通透性进一步增加,加重细胞毒性[53]。
质子海绵效应是指当溶酶体内的氢离子浓度指数下降时,溶酶体能捕获大量质子,并引起氯离子和水分子内流,导致溶酶体渗透性肿胀,最终引起溶酶体破裂。研究表明,位于表面的氨基能为PS-NH2提供阳离子表面电荷使得颗粒在溶酶体中产生质子海绵效应,导致溶酶体质子化,并引起溶酶体肿胀[54]。而在Meindl的实验中却只有未修饰的PS-NPs引起溶酶体损伤[37],这可能是因为蛋白冠的影响。当蛋白冠存在时,带正电荷的PS-NH2起初不会引起细胞损伤,直到进入溶酶体后蛋白冠被降解并伴随着溶酶体膨胀,重新暴露的正电荷引起溶酶体膜损伤,导致溶酶体内容物的胞质释放,最终引起组织蛋白酶诱导的细胞凋亡[54]。相比而言,PS-COOH对溶酶体产生的损伤就小得多[55]。这是由于PS-COOH可以通过触发溶酶体应激来减少ROS[45],从而避免因ROS产生过多引起的溶酶体损伤。文献报道,PS-COOH暴露几乎不引起氧化应激反应,对溶酶体形态也没有明显损伤,但会使溶酶体硫酸酯酶活性发生变化[55]。而短时间内酶活性下降比长时间下降得更明显,这与巨噬细胞短时间暴露于PS-NPs时组织蛋白酶B的下降相一致[56]。由此可见,在生物体内普通型PS-NPs对溶酶体的损伤最早发生,随着PS-NH2携带的蛋白冠被溶酶体降解将引起最强烈的损伤,而PS-COOH仅引起溶酶体酶活性改变。
3.4 DNA损伤
DNA损伤是PS-NPs暴露后可能引起的另一重要潜在毒性效应。被核膜包围的DNA可能与PS-NPs直接接触而受损;也可能因氧化应激产生的ROS与细胞内DNA碱基发生反应,间接诱发DNA的损伤和断裂。此外,PS-NPs还可引起细胞周期阻滞并诱导DNA复制或修复机制受损[57]。相关研究表明,PS-NPs能引起洋葱根细胞有丝分裂细胞周期中G2/M期停滞,并产生细胞毒性(有丝分裂指数降低)和遗传毒性(细胞遗传学异常和微核形成)[58];同时,还可引起细胞周期S期停滞并改变与细胞周期相关的蛋白表达[33]。细胞周期阻滞有助于维持基因的稳定性,但若在此期间未能成功修复损伤的DNA,则会诱发凋亡。因此,PS-NPs可能通过诱发氧化应激使DNA损伤并引起细胞周期阻滞,进而引发细胞凋亡。
已有多项研究表明,PS-NH2比未修饰和羧基化的PS-NPs具有更强的遗传毒性[44]。Paget等[59]的研究发现,PS-NH2显著增加肺上皮细胞和人巨噬细胞的DNA损伤水平并引起DNA双链断裂。除此之外,PS-NH2的暴露还会影响细胞有丝分裂过程中细胞骨架和染色体重组,细胞周期的G0/G1期延长和细胞周期蛋白表达水平下降[60]。然而,50 nm PS-COOH作用于人宫颈腺癌细胞(human cervical adenocarcinoma cell, HeLa)和小鼠胚胎成纤维细胞(mouse embryonic fibroblast cell, NIH 3T3)时未出现明显的遗传毒性[60-61]。值得注意的是,同为50 nm PS-COOH作用的小鼠单核巨噬细胞却增加了其DNA的损伤水平[62],这表明PS-COOH的差异遗传毒性可能与作用细胞类型有关。另有研究发现,未修饰的PS-NPs会引起成纤维细胞DNA损伤并导致微核和核芽的形成增加[63],而PS-COOH没有增加卵巢K1细胞微核的形成[61],这说明普通型PS-NPs可能更易引起微核的增加。
3.5 蛋白质功能抑制
几乎所有类型的纳米塑料都能与蛋白质发生强烈的相互作用并形成蛋白质外壳,从而影响它们的生物运输和毒性[64],其中肌动蛋白是PS-NPs最常见的结合蛋白。当PS-NPs与肌动蛋白结合时可以抑制肌动蛋白的功能,如细胞信号传导、囊泡和细胞器的运输、细胞连接等[65]。同时,由PS-NPs引起的氧化应激还会引起肌动蛋白骨架重组并使溶酶体运输中断,引起自噬体增加[66]。此外,PS-NPs还可以通过抑制某些蛋白质(如质膜ATP结合盒转运蛋白等)的活性造成细胞不良影响[48]。
3.6 其他
除上述细胞毒性外,PS-NPs还会引起细胞内钙离子水平显著增加,且不是由机械因素激活的[37]。细胞内钙离子水平的增加和细胞毒性通常是相关联的,当细胞内钙离子持续升高会破坏线粒体结构和功能,促使自由基生成并可能引起细胞凋亡,在Tang等[22]的实验中也证实了这点。同时,PS-NPs还会对离子通道产生急性影响,表现为基底外侧钾离子通道的激活和氯离子分泌的变化[67]。此外,PS-NPs还会被内质网吞噬,诱导内质网应激[49];影响细胞中蛋白质、脂质和核酸的占比[50];引起脂质过氧化[49]、脂质沉积和脂质体破裂[50];破坏质膜完整性[37],引起细胞膜通透性增加[32]或膜穿孔[41];也可能激活炎症基因转录并诱导促炎细胞因子白细胞介素-8、核因子-κB和肿瘤坏死因子-α的显著上调[33],从而引发相关细胞毒性。
4. 影响PS-NPs对细胞产生生物学效应的因素
PS-NPs的生物效应受到各种粒子参数的影响,一般来说,小尺寸、小团聚体和表面正电荷会产生更大的细胞毒性。同时,当PS-NPs作用于不同细胞时产生的毒性也有所不相同。
4.1 粒径大小
粒径大小是PS-NPs最主要的参数之一,也是影响细胞摄取PS-NPs的主要因素。一般来说,PS-NPs的粒径越小,其表面积就越大,而较高的表面积能使PS-NPs的反应活性增加,从而对机体和细胞产生更大的毒性,这已在研究中得到证实[68]。此外,粒径大小还能影响促炎因子的释放。有相关研究表明,在人单核细胞中白细胞介素-6的分泌随着PS-NPs粒径的增大而增加,而白细胞介素-8的分泌则呈相反的趋势,这可能是由于膜损伤产生的差异结果[69]。
4.2 化学修饰及电荷
PS-NPs最常见的表面化学修饰是氨基修饰和羧基修饰,其中位于表面的氨基能为PS-NH2提供阳离子表面电荷,而羧基修饰的PS-COOH则表现为阴离子表面电荷,且通常情况下PS-NH2会比PS-COOH具有更强烈的细胞毒性[41]。据统计,带正电荷的PS-NPs产生阳性结果的研究占86%,而带负电荷的仅占36%,未修饰的占57%[70]。不同化学修饰和表面电荷的PS-NPs除了引起氧化应激、炎症反应[70]、溶酶体障碍、DNA损伤、凋亡和自噬外,还会影响PS-NPs在细胞中的转运[68]。研究发现,在上皮细胞中带正电荷的PS-NPs转运速率远快于负电荷,这可能是由于带负电荷的胞外质膜蛋白片使上皮细胞通常呈现净负电荷表面导致[71]。这也解释了带正电荷的粒子比带负电荷或中性的粒子更容易被细胞膜吸引的原因。
除此之外,PS-NPs的物理化学特性和生物活性会随其老化发生改变。研究表明,老化过程诱导了PS-NPs的表面氧化,导致亲水性增加和更多的表面负电荷聚集[72]。当45~70 nm PS-NPs作用于神经外胚层干细胞时,与“新鲜”PS-NPs相比,“老化”的PS-NPs(储存6个月)表现出更强的毒性和细胞内蓄积,这可能是由于大团聚体的形成和/或吸附生物活性化合物[73]。而紫外老化处理却使50 nm PS-NPs表面出现裂纹,平均粒径变小,但同样使细胞毒性增加[72]。另一项研究却发现100 nm老化的PS-NPs作用于大肠杆菌时,会抑制ROS生成,恢复三磷酸腺苷酶活性,并能减轻共同暴露下银离子的细胞毒性,起到了保护作用[74]。产生不同结果的原因可能是作用细胞类型不同和制备老化PS-NPs的过程存在差异导致。
4.3 蛋白冠
当PS-NPs接触到生物液体(如血清培养基或血液等)后,其表面会迅速被一层或多层蛋白质覆盖,形成蛋白冠。蛋白冠可直接传导信号,也可通过掩盖纳米颗粒裸露表面的特性来延迟其影响[54]。除此之外,由血淋巴蛋白形成的蛋白冠还可增强PS-NPs的细胞毒性,导致细胞损伤和ROS产生增加[75]。产生上述功能的差异可能是由于组成蛋白冠的蛋白质种类不同。Grassi等[76]通过双向电泳和质谱分析,在蛋白冠中检测到多种蛋白(如拓扑小体、肌动蛋白、连接蛋白等)且具有不同的功能,并发现蛋白冠的存在增强了PS-NH2的细胞结合能力,却抑制了PS-COOH的细胞结合能力。而未修饰的PS-NPs悬浮在富含血清的细胞培养基中会产生负电荷也可能是由于蛋白冠的影响[30,51,59]。
4.4 作用细胞类型
研究发现,小鼠单核巨噬细胞(mouse monocyte macrophage cell, RAW 264.7)和人支气管上皮细胞(human bronchial epithelial cell, BEAS-2B)对60 nm PS-NH2非常敏感,而人微血管内皮细胞(human microvascular endothelial cell, HMEC)、小鼠肝癌细胞(mouse hepatoma Hepa-1c1c7 cell, Hepa-1)和大鼠肾上腺髓质嗜铬细胞(pheochromocytoma cell, PC-12)却表现出相对耐受。此外,同样的PS-NH2诱导RAW 264.7和BEAS-2B细胞死亡的性质也不同,分别表现为凋亡和坏死特征[51]。在另一项研究中,相同暴露条件下的人胎盘绒毛膜癌细胞(human placental choriocarcinoma cell, BeWo b30)的代谢活性比结肠癌细胞(human adenocarcinoma cell, Caco-2)和结肠腺癌HT29细胞(colon adenocarcinoma HT29 cell, HT29-MTXE12)更容易受50 nm COOH-PS的影响[61]。同时,无论是PS-NH2还是PS-COOH对正常NIH 3T3细胞的影响都比癌症HeLa细胞更明显[60]。因此,作用细胞类型的不同是PS-NPs诱导毒性差异的因素。
4.5 其他
团聚是影响纳米塑料毒性的另一个潜在因素。纳米塑料越分散,越容易进入细胞,如果聚集在一起,便很难穿透组织或细胞,生物利用度也会降低[77]。然而,有研究发现团聚后的纳米粒子还可能造成物理堵塞,产生负面影响[78]。因此,PS-NPs的团聚是否一定会带来更大的细胞毒性还有待深入研究。此外,纳米粒子的形状和状态也是影响因素之一,其中球型[79]和雾化状态[80]的纳米粒子具有更高的细胞毒性。因此在评价PS-NPs的细胞毒性时应进行更全面、更仔细地分类讨论。
5. PS-NPs对模式动物的体内毒理学研究进展
5.1 呼吸毒性
无论是全身暴露还是通过气道暴露,肺都是PS-NPs的重点靶器官[81],因此对PS-NPs呼吸毒性的研究应得到更多的重视。在大鼠吸入暴露14 d后,炎症蛋白在肺组织中的表达以浓度依赖方式增加[82],从而引起肺部损伤。而在小鼠模型中,暴露于100 nm PS-NH2还会导致肺泡壁增厚和肺间质纤维化,并引起肺结构的显著改变[83]。由此可见,PS-NPs的呼吸毒性可能主要表现为肺部炎症和肺纤维化。
5.2 肝肾毒性
肝和肾作为PS-NPs的普遍蓄积部位,极易受其影响[83]。当大鼠鼻内给药20 nm PS-NPs后,会引起肝细胞胞质空泡、肾小管扩张[84]。同样,在小鼠体内100 nm PS-NH2会导致肝损伤,出现免疫细胞浸润、肝细胞空泡化、核固缩和肝细胞正弦间隙增大。肾脏的损害主要表现在肾小管和肾小球的萎缩并伴随炎症反应[83],不同的肾脏表现可能与PS-NPs的粒径相关。另有实验证明,PS-NPs诱导的肾毒性可能是由氧化应激和炎症反应介导的[85]。
5.3 神经毒性
研究表明,不论急性(7 d)还是慢性(7周)暴露于70 nm PS-NPs均会导致斑马鱼行为中断,并引发神经毒性反应[86]。PS-NPs已被证实会沉积在大脑中,并引起小鼠行为障碍[87]。此外,暴露于100 nm PS-NH2的小鼠大脑中可以观察到大脑皮层中神经元的异常分层和以核固缩为特征的畸形神经元[83]。然而,PS-NPs除了会引起直接暴露对象的神经毒性外,还会在聚苯乙烯微塑料的协助下进入胎儿体内,出现在胎儿大脑,尤其是丘脑中,产生神经毒性,引发焦虑样行为[88]。
5.4 肠道毒性
脑-肠轴是胃肠道和中枢神经系统之间的复杂双向网络,由微生物、免疫系统、神经元和激素组成,对生物体的健康和发育有着深远影响。研究表明,44 nm PS-NPs会导致斑马鱼肠道内的微生物组成和功能改变并伴有免疫功能紊乱,造成由神经递质代谢物改变介导的脑-肠轴损坏[89]。同时,100 nm PS-NPs也能诱导斑马鱼肠道免疫细胞功能障碍,并增加微生物群的丰度[90]。这说明PS-NPs可能是通过影响肠道免疫功能和微生物群造成肠道损伤,影响脑-肠轴的健康。除此之外,PS-NPs还会破坏大鼠回肠和结肠上皮组织,使肠绒毛变短[83]。
5.5 胚胎毒性
20 nm PS-NPs通过吸入途径进入母体后,会从母亲的肺部转移到全身组织,并穿过胎盘屏障进入胎儿和胎儿器官[12]。然而,50 nm PS-COOH却无法通过胎盘屏障[61]。这说明PS-NPs能否通过胎盘屏障可能取决于粒径大小,这在金纳米颗粒中也得到验证[91-92]。值得注意的是,纳米颗粒在微颗粒的协助下可以穿透胎盘屏障[88],这说明PS-NPs与其他物质的共同暴露可能会加重其本身的健康损害。
5.6 其他
除了上述影响外,PS-NPs还会引起脂质代谢和循环系统异常。研究表明,雄性小鼠通过尾静脉注射、灌胃或肺灌注100 nm PS-NPs后,均可在血液和尿液中检测到[93]。同时PS-NPs暴露会进入斑马鱼幼鱼体内并降低心率[94],甚至引起鲤鱼心肌组织炎症和心肌细胞凋亡[95]。而100 nm PS-NH2的暴露使小鼠出现白细胞计数减少、血小板计数上调和血浆总胆固醇降低等免疫系统和脂质代谢的影响[83]。
6. 总结与展望
近年来,PS-NPs已被广泛应用于工业、消费品包装材料等多个领域且极易被释放到环境中,形成新型环境污染物,从而增加普通人群接触机会,因此PS-NPs对生物体造成的健康效应日益引起关注。细胞毒性是PS-NPs生物安全性评估的重要指标之一,也是人类健康安全评价的前期研究基础。目前的研究已探讨了PS-NPs对细胞产生的氧化损伤作用以及对溶酶体、线粒体和DNA等靶点的毒性损伤,这在一定水平上推动了纳米材料的环境健康安全性评价发展,为纳米材料的可持续发展提供理论实验依据。现阶段对PS-NPs的毒性研究仍处于不断发展的阶段,还有许多未知的领域需要探索。需从多角度、多学科出发,去更深入地研究其毒性作用及相关机制,以期完善PS-NPs的环境风险评价及提高对其潜在健康风险的科学认识。
-
[1] PlaticsEurope. Plastics-the Facts 2020 an Analysis of European Plastics Production, Demand and Waste Data[EB/OL]. [2023-02-01]. https://www.plasticseurope.org/en/resources/market-data
[2] KUMAR M, CHEN H, SARSAIYA S, et al. Current research trends on micro- and nano-plastics as an emerging threat to global environment: a review[J]. J Hazard Mater, 2021, 409: 124967. doi: 10.1016/j.jhazmat.2020.124967
[3] DI M, WANG J. Microplastics in surface waters and sediments of the Three Gorges Reservoir, China[J]. Sci Total Environ, 2018, 616-617: 1620-1627. doi: 10.1016/j.scitotenv.2017.10.150
[4] RAI P K, LEE J, BROWN R J C, et al. Environmental fate, ecotoxicity biomarkers, and potential health effects of micro- and nano-scale plastic contamination[J]. J Hazard Mater, 2021, 403: 123910. doi: 10.1016/j.jhazmat.2020.123910
[5] PAUL M B, STOCK V, CARA-CARMONA J, et al. Micro- and nanoplastics - current state of knowledge with the focus on oral uptake and toxicity[J]. Nanoscale Adv, 2020, 2(10): 4350-4367. doi: 10.1039/D0NA00539H
[6] SHI Q, TANG J, WANG L, et al. Combined cytotoxicity of polystyrene nanoplastics and phthalate esters on human lung epithelial A549 cells and its mechanism[J]. Ecotoxicol Environ Saf, 2021, 213: 112041. doi: 10.1016/j.ecoenv.2021.112041
[7] LI Z, YI X, ZHOU H, et al. Combined effect of polystyrene microplastics and dibutyl phthalate on the microalgae Chlorella pyrenoidosa[J]. Environ Pollut, 2020, 257: 113604. doi: 10.1016/j.envpol.2019.113604
[8] 苑文珂. 聚苯乙烯微/纳米塑料对重金属的吸附行为及其对两种典型水生生物的生态毒性研究[D]. 武汉: 中国科学院大学(中国科学院武汉植物园), 2020. YUAN W K. A study on the adsorption behaviors of micro/nano-plastics for heavy metals and their ecotoxicity toward two typical aquatic organisms[D]. Wuhan: University of Chinese Academy of Sciences (Wuhan Botanical Garden, Chinese Academy of Sciences), 2020.
[9] COX K D, COVERNTON G A, DAVIES H L, et al. Human consumption of microplastics[J]. Environ Sci Technol, 2019, 53(12): 7068-7074. doi: 10.1021/acs.est.9b01517
[10] SCHWABL P, KÖPPEL S, KÖNIGSHOFER P, et al. Detection of various microplastics in human stool: a prospective case series[J]. Ann Intern Med, 2019, 171(7): 453-457. doi: 10.7326/M19-0618
[11] RIST S, CARNEY ALMROTH B, HARTMANN N B, et al. A critical perspective on early communications concerning human health aspects of microplastics[J]. Sci Total Environ, 2018, 626: 720-726. doi: 10.1016/j.scitotenv.2018.01.092
[12] FOURNIER S B, D'ERRICO J N, ADLER D S, et al. Nanopolystyrene translocation and fetal deposition after acute lung exposure during late-stage pregnancy[J]. Part Fibre Toxicol, 2020, 17(1): 55. doi: 10.1186/s12989-020-00385-9
[13] HÜFFER T, WENIGER A K, HOFMANN T. Data on sorption of organic compounds by aged polystyrene microplastic particles[J]. Data Brief, 2018, 18: 474-479. doi: 10.1016/j.dib.2018.03.053
[14] SCHIRINZI G F, PÉREZ-POMEDA I, SANCHÍS J, et al. Cytotoxic effects of commonly used nanomaterials and microplastics on cerebral and epithelial human cells[J]. Environ Res, 2017, 159: 579-587. doi: 10.1016/j.envres.2017.08.043
[15] ZATORSKA-PLACHTA M, ŁAZARSKI G, MAZIARZ U, et al. Encapsulation of curcumin in polystyrene-based nanoparticles-drug loading capacity and cytotoxicity[J]. ACS Omega, 2021, 6(18): 12168-12178. doi: 10.1021/acsomega.1c00867
[16] SHANG L, NIENHAUS K, NIENHAUS G U. Engineered nanoparticles interacting with cells: size matters[J]. J Nanobiotechnol, 2014, 12: 5. doi: 10.1186/1477-3155-12-5
[17] KUHN D A, VANHECKE D, MICHEN B, et al. Different endocytotic uptake mechanisms for nanoparticles in epithelial cells and macrophages[J]. Beilstein J Nanotechnol, 2014, 5: 1625-1636. doi: 10.3762/bjnano.5.174
[18] DING Y, ZHANG R, LI B, et al. Tissue distribution of polystyrene nanoplastics in mice and their entry, transport, and cytotoxicity to GES-1 cells[J]. Environ Pollut, 2021, 280: 116974. doi: 10.1016/j.envpol.2021.116974
[19] GEISER M, ROTHEN-RUTISHAUSER B, KAPP N, et al. Ultrafine particles cross cellular membranes by nonphagocytic mechanisms in lungs and in cultured cells[J]. Environ Health Perspect, 2005, 113(11): 1555-1560. doi: 10.1289/ehp.8006
[20] LIU L, XU K, ZHANG B, et al. Cellular internalization and release of polystyrene microplastics and nanoplastics[J]. Sci Total Environ, 2021, 779: 146523. doi: 10.1016/j.scitotenv.2021.146523
[21] SIPOS A, KIM K J, SIOUTAS C, et al. Evidence for nanoparticle-induced lysosomal dysfunction in lung adenocarcinoma (A549) cells[J]. Int J Mol Sci, 2019, 20(21): 5253. doi: 10.3390/ijms20215253
[22] TANG Q, LI T, CHEN K, et al. PS-NPs induced neurotoxic effects in SHSY-5Y cells via autophagy activation and mitochondrial dysfunction[J]. Brain Sci, 2022, 12(7): 952. doi: 10.3390/brainsci12070952
[23] SONG W, POPP L, YANG J, et al. The autophagic response to polystyrene nanoparticles is mediated by transcription factor EB and depends on surface charge[J]. J Nanobiotechnol, 2015, 13: 87. doi: 10.1186/s12951-015-0149-6
[24] REMAUT K, OORSCHOT V, BRAECKMANS K, et al. Lysosomal capturing of cytoplasmic injected nanoparticles by autophagy: an additional barrier to non viral gene delivery[J]. J Control Release, 2014, 195: 29-36. doi: 10.1016/j.jconrel.2014.08.002
[25] SIPOS A, KIM K J, CHOW R H, et al. Alveolar epithelial cell processing of nanoparticles activates autophagy and lysosomal exocytosis[J]. Am J Physiol Lung Cell MOL Physiol, 2018, 315(2): L286-L300. doi: 10.1152/ajplung.00108.2018
[26] LU Y Y, LI H, REN H, et al. Size-dependent effects of polystyrene nanoplastics on autophagy response in human umbilical vein endothelial cells[J]. J Hazard Mater, 2022, 421: 126770. doi: 10.1016/j.jhazmat.2021.126770
[27] WANG F, SALVATI A, BOYA P. Lysosome-dependent cell death and deregulated autophagy induced by amine-modified polystyrene nanoparticles[J]. Open Biol, 2018, 8(4): 170271. doi: 10.1098/rsob.170271
[28] MARTINEZ LEGASPI S, SEGATORI L. Aggregation behavior of nanoparticle-peptide systems affects autophagy[J]. Bioconjugate Chem, 2019, 30(7): 1986-1997. doi: 10.1021/acs.bioconjchem.9b00266
[29] LOOS C, SYROVETS T, MUSYANOVYCH A, et al. Amino-functionalized nanoparticles as inhibitors of mTOR and inducers of cell cycle arrest in leukemia cells[J]. Biomaterials, 2014, 35(6): 1944-1953. doi: 10.1016/j.biomaterials.2013.11.056
[30] CHIU H W, XIA T, LEE Y H, et al. Cationic polystyrene nanospheres induce autophagic cell death through the induction of endoplasmic reticulum stress[J]. Nanoscale, 2015, 7(2): 736-746. doi: 10.1039/C4NR05509H
[31] SHARMA A, GOREY B, CASEY A. In vitro comparative cytotoxicity study of aminated polystyrene, zinc oxide and silver nanoparticles on a cervical cancer cell line[J]. Drug Chem Toxicol, 2019, 42(1): 9-23. doi: 10.1080/01480545.2018.1424181
[32] BEXIGA M G, VARELA J A, WANG F, et al. Cationic nanoparticles induce caspase 3-, 7- and 9-mediated cytotoxicity in a human astrocytoma cell line[J]. Nanotoxicology, 2011, 5(4): 557-567. doi: 10.3109/17435390.2010.539713
[33] XU M, HALIMU G, ZHANG Q, et al. Internalization and toxicity: a preliminary study of effects of nanoplastic particles on human lung epithelial cell[J]. Sci Total Environ, 2019, 694: 133794. doi: 10.1016/j.scitotenv.2019.133794
[34] HU Q, WANG H, HE C, et al. Polystyrene nanoparticles trigger the activation of p38 MAPK and apoptosis via inducing oxidative stress in zebrafish and macrophage cells[J]. Environ Pollut, 2021, 269: 116075. doi: 10.1016/j.envpol.2020.116075
[35] YAN X, ZHANG Y, LU Y, et al. The complex toxicity of tetracycline with polystyrene spheres on gastric cancer cells[J]. Int J Environ Res Public Health, 2020, 17(8): 2808. doi: 10.3390/ijerph17082808
[36] INKIELEWICZ-STEPNIAK I, TAJBER L, BEHAN G, et al. The role of mucin in the toxicological impact of polystyrene nanoparticles[J]. Materials (Basel), 2018, 11(5): 724. doi: 10.3390/ma11050724
[37] MEINDL C, KUEZNIK T, BÖSCH M, et al. Intracellular calcium levels as screening tool for nanoparticle toxicity[J]. J Appl Toxicol, 2015, 35(10): 1150-1159. doi: 10.1002/jat.3160
[38] LUNOV O, SYROVETS T, LOOS C, et al. Amino-functionalized polystyrene nanoparticles activate the NLRP3 inflammasome in human macrophages[J]. ACS Nano, 2011, 5(12): 9648-9657. doi: 10.1021/nn203596e
[39] XIA T, KOVOCHICH M, BRANT J, et al. Comparison of the abilities of ambient and manufactured nanoparticles to induce cellular toxicity according to an oxidative stress paradigm[J]. Nano Lett, 2006, 6(8): 1794-1807. doi: 10.1021/nl061025k
[40] CHWIERALSKI C E, WELTE T, BÜHLING F. Cathepsin-regulated apoptosis[J]. Apoptosis, 2006, 11(2): 143-149. doi: 10.1007/s10495-006-3486-y
[41] RUENRAROENGSAK P, NOVAK P, BERHANU D, et al. Respiratory epithelial cytotoxicity and membrane damage (holes) caused by amine-modified nanoparticles[J]. Nanotoxicology, 2012, 6(1): 94-108. doi: 10.3109/17435390.2011.558643
[42] RUIZ-PALACIOS M, ALMEIDA M, MARTINS M A, et al. Establishment of a brain cell line (FuB-1) from mummichog (Fundulus heteroclitus) and its application to fish virology, immunity and nanoplastics toxicology[J]. Sci Total Environ, 2020, 708: 134821. doi: 10.1016/j.scitotenv.2019.134821
[43] XIA B, CHEN B, SUN X, et al. Interaction of TiO2 nanoparticles with the marine microalga Nitzschia closterium: growth inhibition, oxidative stress and internalization[J]. Sci Total Environ, 2015, 508: 525-533. doi: 10.1016/j.scitotenv.2014.11.066
[44] QIAN J, HE X, WANG P, et al. Effects of polystyrene nanoplastics on extracellular polymeric substance composition of activated sludge: the role of surface functional groups[J]. Environ Pollut, 2021, 279: 116904. doi: 10.1016/j.envpol.2021.116904
[45] LI L, SUN S, TAN L, et al. Polystyrene nanoparticles reduced ROS and inhibited ferroptosis by triggering lysosome stress and TFEB Nucleus translocation in a size-dependent manner[J]. Nano Lett, 2019, 19(11): 7781-7792. doi: 10.1021/acs.nanolett.9b02795
[46] JEONG S Y, SEOL D W. The role of mitochondria in apoptosis[J]. BMB Rep, 2008, 41(1): 11-22. doi: 10.5483/BMBRep.2008.41.1.011
[47] JOHNSTON H J, SEMMLER-BEHNKE M, BROWN D M, et al. Evaluating the uptake and intracellular fate of polystyrene nanoparticles by primary and hepatocyte cell lines in vitro[J]. Toxicol Appl Pharmacol, 2010, 242(1): 66-78. doi: 10.1016/j.taap.2009.09.015
[48] WU B, WU X, LIU S, et al. Size-dependent effects of polystyrene microplastics on cytotoxicity and efflux pump inhibition in human Caco-2 cells[J]. Chemosphere, 2019, 221: 333-341. doi: 10.1016/j.chemosphere.2019.01.056
[49] DEVILLE S, HONRATH B, TRAN Q T D, et al. Time-resolved characterization of the mechanisms of toxicity induced by silica and amino-modified polystyrene on alveolar-like macrophages[J]. Arch Toxicol, 2020, 94(1): 173-186. doi: 10.1007/s00204-019-02604-5
[50] EFEOGLU E, CASEY A, BYRNE H J. In vitro monitoring of time and dose dependent cytotoxicity of aminated nanoparticles using Raman spectroscopy[J]. Analyst, 2016, 141(18): 5417-5431. doi: 10.1039/C6AN01199C
[51] XIA T, KOVOCHICH M, LIONG M, et al. Cationic polystyrene nanosphere toxicity depends on cell-specific endocytic and mitochondrial injury pathways[J]. ACS Nano, 2008, 2(1): 85-96. doi: 10.1021/nn700256c
[52] OLSSON G M, SVENSSON I, ZDOLSEK J M, et al. Lysosomal enzyme leakage during the hypoxanthine/xanthine oxidase reaction[J]. Virchows Arch B Cell Pathol Incl Mol Pathol, 1989, 56(6): 385-391.
[53] ZHAO M, ANTUNES F, EATON J W, et al. Lysosomal enzymes promote mitochondrial oxidant production, cytochrome c release and apoptosis[J]. Eur J Biochem, 2003, 270(18): 3778-3786. doi: 10.1046/j.1432-1033.2003.03765.x
[54] WANG F, YU L, MONOPOLI M P, et al. The biomolecular corona is retained during nanoparticle uptake and protects the cells from the damage induced by cationic nanoparticles until degraded in the lysosomes[J]. Nanomedicine, 2013, 9(8): 1159-1168. doi: 10.1016/j.nano.2013.04.010
[55] FRÖHLICH E, MEINDL C, ROBLEGG E, et al. Action of polystyrene nanoparticles of different sizes on lysosomal function and integrity[J]. Part Fibre Toxicol, 2012, 9: 26. doi: 10.1186/1743-8977-9-26
[56] OH Y K, SWANSON J A. Different fates of phagocytosed particles after delivery into macrophage lysosomes[J]. J Cell Biol, 1996, 132(4): 585-593. doi: 10.1083/jcb.132.4.585
[57] RUBIO L, MARCOS R, HERNÁNDEZ A. Potential adverse health effects of ingested micro- and nanoplastics on humans. Lessons learned from in vivo and in vitro mammalian models[J]. J Toxicol Environ Health Part B Crit Rev, 2020, 23(2): 51-68. doi: 10.1080/10937404.2019.1700598
[58] GIORGETTI L, SPANÒ C, MUCCIFORA S, et al. Exploring the interaction between polystyrene nanoplastics and Allium cepa during germination: Internalization in root cells, induction of toxicity and oxidative stress[J]. Plant Physiol Biochem, 2020, 149: 170-177. doi: 10.1016/j.plaphy.2020.02.014
[59] PAGET V, DEKALI S, KORTULEWSKI T, et al. Specific uptake and genotoxicity induced by polystyrene nanobeads with distinct surface chemistry on human lung epithelial cells and macrophages[J]. PLoS One, 2015, 10(4): e0123297. doi: 10.1371/journal.pone.0123297
[60] LIU Y, LI W, LAO F, et al. Intracellular dynamics of cationic and anionic polystyrene nanoparticles without direct interaction with mitotic spindle and chromosomes[J]. Biomaterials, 2011, 32(32): 8291-8303. doi: 10.1016/j.biomaterials.2011.07.037
[61] HESLER M, AENGENHEISTER L, ELLINGER B, et al. Multi-endpoint toxicological assessment of polystyrene nano- and microparticles in different biological models in vitro[J]. Toxicol in Vitro, 2019, 61: 104610. doi: 10.1016/j.tiv.2019.104610
[62] ZHANG M, LI J, XING G, et al. Variation in the internalization of differently sized nanoparticles induces different DNA-damaging effects on a macrophage cell line[J]. Arch Toxicol, 2011, 85(12): 1575-1588. doi: 10.1007/s00204-011-0725-y
[63] POMA A, VECCHIOTTI G, COLAFARINA S, et al. In vitro genotoxicity of polystyrene nanoparticles on the human fibroblast Hs27 cell line[J]. Nanomaterials (Basel), 2019, 9(9): 1299. doi: 10.3390/nano9091299
[64] GHOSH G, PANICKER L. Protein-nanoparticle interactions and a new insight[J]. Soft Matter, 2021, 17(14): 3855-3875. doi: 10.1039/D0SM02050H
[65] EHRENBERG M, MCGRATH J L. Binding between particles and proteins in extracts: implications for microrheology and toxicity[J]. Acta Biomater, 2005, 1(3): 305-315. doi: 10.1016/j.actbio.2005.02.002
[66] STERN S T, ADISESHAIAH P P, CRIST R M. Autophagy and lysosomal dysfunction as emerging mechanisms of nanomaterial toxicity[J]. Part Fibre Toxicol, 2012, 9: 20. doi: 10.1186/1743-8977-9-20
[67] MCCARTHY J, GONG X, NAHIRNEY D, et al. Polystyrene nanoparticles activate ion transport in human airway epithelial cells[J]. Int J Nanomed, 2011, 6: 1343-1356.
[68] YACOBI N R, DEMAIO L, XIE J, et al. Polystyrene nanoparticle trafficking across alveolar epithelium[J]. Nanomedicine, 2008, 4(2): 139-145. doi: 10.1016/j.nano.2008.02.002
[69] PRIETL B, MEINDL C, ROBLEGG E, et al. Nano-sized and micro-sized polystyrene particles affect phagocyte function[J]. Cell Biol Toxicol, 2014, 30(1): 1-16. doi: 10.1007/s10565-013-9265-y
[70] HEDDAGAARD F E, MØLLER P. Hazard assessment of small-size plastic particles: is the conceptual framework of particle toxicology useful?[J]. Food Chem Toxicol, 2020, 136: 111106. doi: 10.1016/j.fct.2019.111106
[71] ROJANASAKUL Y, WANG L Y, BHAT M, et al. The transport barrier of epithelia: a comparative study on membrane permeability and charge selectivity in the rabbit[J]. Pharm Res, 1992, 9(8): 1029-1034. doi: 10.1023/A:1015802427428
[72] 何艺欣, 唐炳然, 张丽雪, 等. 老化聚苯乙烯纳米塑料对铜绿微囊藻的影响[J]. 中国环境科学, 2022, 42(12): 5877-5884. doi: 10.3969/j.issn.1000-6923.2022.12.045 HE Y X, TANG B R, ZHANG L X, et al. Effects of aged polystyrene nanoplastics to Microcystis aeruginosa[J]. China Environ Sci, 2022, 42(12): 5877-5884. doi: 10.3969/j.issn.1000-6923.2022.12.045
[73] MURALI K, KENESEI K, LI Y, et al. Uptake and bio-reactivity of polystyrene nanoparticles is affected by surface modifications, ageing and LPS adsorption: in vitro studies on neural tissue cells[J]. Nanoscale, 2015, 7(9): 4199-4210. doi: 10.1039/C4NR06849A
[74] SUN C, ZHANG W, DING R, et al. Mechanism of low concentrations of polystyrene microplastics influence the cytotoxicity of Ag ions to Escherichia coli[J]. Chemosphere, 2020, 253: 126705. doi: 10.1016/j.chemosphere.2020.126705
[75] CANESI L, CIACCI C, FABBRI R, et al. Interactions of cationic polystyrene nanoparticles with marine bivalve hemocytes in a physiological environment: role of soluble hemolymph proteins[J]. Environ Res, 2016, 150: 73-81. doi: 10.1016/j.envres.2016.05.045
[76] GRASSI G, LANDI C, DELLA TORRE C, et al. Proteomic profile of the hard corona of charged polystyrene nanoparticles exposed to sea urchin Paracentrotus lividus coelomic fluid highlights potential drivers of toxicity[J]. Environ Sci Nano, 2019, 6(10): 2937-2947. doi: 10.1039/C9EN00824A
[77] ZOOK J M, MACCUSPIE R I, LOCASCIO L E, et al. Stable nanoparticle aggregates/agglomerates of different sizes and the effect of their size on hemolytic cytotoxicity[J]. Nanotoxicology, 2011, 5(4): 517-530. doi: 10.3109/17435390.2010.536615
[78] ZHAO T, TAN L, ZHU X, et al. Size-dependent oxidative stress effect of nano/micro-scaled polystyrene on Karenia mikimotoi[J]. Mar Pollut Bull, 2020, 154: 111074. doi: 10.1016/j.marpolbul.2020.111074
[79] KAGA S, TRUONG N P, ESSER L, et al. Influence of size and shape on the biodistribution of nanoparticles prepared by polymerization-induced self-assembly[J]. Biomacromolecules, 2017, 18(12): 3963-3970. doi: 10.1021/acs.biomac.7b00995
[80] FRÖHLICH E, BONSTINGL G, HÖFLER A, et al. Comparison of two in vitro systems to assess cellular effects of nanoparticles-containing aerosols[J]. Toxicol Vitro, 2013, 27(1): 409-417. doi: 10.1016/j.tiv.2012.08.008
[81] SARLO K, BLACKBURN K L, CLARK E D, et al. Tissue distribution of 20 nm, 100 nm and 1000 nm fluorescent polystyrene latex nanospheres following acute systemic or acute and repeat airway exposure in the rat[J]. Toxicology, 2009, 263(2/3): 117-126.
[82] LIM D, JEONG J, SONG K S, et al. Inhalation toxicity of polystyrene micro(nano)plastics using modified OECD TG 412[J]. Chemosphere, 2021, 262: 128330. doi: 10.1016/j.chemosphere.2020.128330
[83] XU D, MA Y, HAN X, et al. Systematic toxicity evaluation of polystyrene nanoplastics on mice and molecular mechanism investigation about their internalization into Caco-2 cells[J]. J Hazard Mater, 2021, 417: 126092. doi: 10.1016/j.jhazmat.2021.126092
[84] HUANG J, DONG G, LIANG M, et al. Toxicity of micro(nano)plastics with different size and surface charge on human nasal epithelial cells and rats via intranasal exposure[J]. Chemosphere, 2022, 307(Pt 4): 136093.
[85] MENG X, ZHANG J, WANG W, et al. Effects of nano- and microplastics on kidney: Physicochemical properties, bioaccumulation, oxidative stress and immunoreaction[J]. Chemosphere, 2022, 288(Pt 3): 132631.
[86] SARASAMMA S, AUDIRA G, SIREGAR P, et al. Nanoplastics cause neurobehavioral impairments, reproductive and oxidative damages, and biomarker responses in zebrafish: throwing up alarms of wide spread health risk of exposure[J]. Int J Mol Sci, 2020, 21(4): 1410. doi: 10.3390/ijms21041410
[87] LIU X, ZHAO Y, DOU J, et al. Bioeffects of inhaled nanoplastics on neurons and alteration of animal behaviors through deposition in the brain[J]. Nano Lett, 2022, 22(3): 1091-1099. doi: 10.1021/acs.nanolett.1c04184
[88] YANG D, ZHU J, ZHOU X, et al. Polystyrene micro- and nano-particle coexposure injures fetal thalamus by inducing ROS-mediated cell apoptosis[J]. Environ Int, 2022, 166: 107362. doi: 10.1016/j.envint.2022.107362
[89] TENG M, ZHAO X, WANG C, et al. Polystyrene nanoplastics toxicity to zebrafish: dysregulation of the brain-intestine-microbiota axis[J]. ACS Nano, 2022, 16(5): 8190-8204. doi: 10.1021/acsnano.2c01872
[90] GU W, LIU S, CHEN L, et al. Single-cell RNA sequencing reveals size-dependent effects of polystyrene microplastics on immune and secretory cell populations from zebrafish intestines[J]. Environ Sci Technol, 2020, 54(6): 3417-3427. doi: 10.1021/acs.est.9b06386
[91] TSYGANOVA N A, KHAIRULLIN R M, TERENTYUK G S, et al. Penetration of pegylated gold nanoparticles through rat placental barrier[J]. Bull Exp Biol Med, 2014, 157(3): 383-385. doi: 10.1007/s10517-014-2572-3
[92] TIAN X, ZHU M, DU L, et al. Intrauterine inflammation increases materno-fetal transfer of gold nanoparticles in a size-dependent manner in murine pregnancy[J]. Small, 2013, 9(14): 2432-2439. doi: 10.1002/smll.201300817
[93] SUN W, JIN C, BAI Y, et al. Blood uptake and urine excretion of nano- and micro-plastics after a single exposure[J]. Sci Total Environ, 2022, 848: 157639. doi: 10.1016/j.scitotenv.2022.157639
[94] PITT J A, KOZAL J S, JAYASUNDARA N, et al. Uptake, tissue distribution, and toxicity of polystyrene nanoparticles in developing zebrafish (Danio rerio)[J]. Aquat Toxicol, 2018, 194: 185-194. doi: 10.1016/j.aquatox.2017.11.017
[95] WU H, GUO J, YAO Y, et al. Polystyrene nanoplastics induced cardiomyocyte apoptosis and myocardial inflammation in carp by promoting ROS production[J]. Fish Shellfish Immunol, 2022, 125: 1-8. doi: 10.1016/j.fsi.2022.04.048
-
期刊类型引用(1)
1. 王佳博,李榕,娜孜拉·赛提尼亚孜,刘成清,杨楠,闫琪. 聚苯乙烯微塑料致雄性小鼠生殖损伤及铁死亡的作用机制. 环境与职业医学. 2025(02): 224-231 .  本站查看
本站查看
其他类型引用(1)



 下载:
下载:

