Dietary exposure level of to perfluorinated compounds and its relationship with perinatal adverse events in pregnant women in Xuhui District of Shanghai
-
摘要:背景
全氟化合物(PFCs)是具有持久污染性的化合物。妇女孕期膳食暴露可能影响孕期不良事件及产后抑郁的发生风险。
目的评估上海市徐汇区孕期妇女PFCs的膳食暴露风险,膳食PFCs暴露与孕期不良事件及产后抑郁风险的关系。
方法本研究是一项小型队列研究。2017年7月—2018年9月纳入徐汇区常住的孕期妇女,采用询问调查的方式进行问卷数据收集。在纳入时收集调查对象的基本信息、膳食信息,其中膳食信息通过食品频率调查问卷(FFQ)调查获得。在纳入对象产后42 d内对其进行回访,收集孕期不良事件的发生和产后抑郁情况。根据实际的膳食调查结果,对纳入对象日常食用量较大的市售主食类、禽畜肉类、水产品类、蔬菜类、乳与乳制品、禽蛋类等食品进行采样和PFCs水平检测。采样点覆盖徐汇区所有街道,包括农贸市场、超市、便利店、商铺等类型。根据膳食调查结果和实验室检测结果,计算PFCs人均日暴露水平和危害指数(HR)。使用logistic回归估计PFCs暴露水平与发生孕期发生不良事件和产后抑郁风险的关系,并根据四分位间距将PFCs暴露水平分成4组,分别计算OR值和趋势
P 值。结果本研究纳入孕妇345名,平均年龄为(29.61±4.92)岁,其中26.37%的研究对象至少发生过一项孕期不良事件,30.14%的对象《爱丁堡产后抑郁自测量表》(EPDS)得分≥12分。采集食品样品共132件,检出PFCs主要分布在乳与乳制品、禽肉、畜肉、禽蛋、淡水产品和海水产品中,其中淡水产品检出率最高,达到100%。PFCs在检出的食物中平均水平为0.02~2.10 μg·kg−1。PFCs的HR为4.44。在产后抑郁风险与全氟辛烷磺酸(PFOS)暴露的模型中观察到OR值变大的趋势(
P 趋势=0.02)。结论膳食PFCs的暴露对孕妇可能存在健康风险。本研究提示上海市徐汇区孕期妇女可以适量减少淡水产品的摄入,以降低PFCs的暴露风险。
Abstract:BackgroundPerfluorinated compounds (PFCs) are persistent organic pollutants. Dietary exposure to PFCs among pregnant women may lead to elevated risks of adverse events during pregnancy and postpartum depression.
ObjectiveTo estimate potential risk of dietary exposure to PFCs among pregnant women in Xuhui District, Shanghai, and the relationship between dietary PFCs exposure and risks of adverse events during pregnancy and postpartum depression.
MethodsThis study was a small cohort study which recruited women residing in Xuhui District from July 2017 to September 2018. All information was collected through questionnaires by trained investigators. Basic information and dietary information were collected at the time of inclusion, where the dietary information was obtained through the Food Frequency Questionnaire (FFQ). A follow-up visit was conducted within 42 d after delivery to collect the occurrence of adverse events during pregnancy and postpartum depression. According to the results of dietary survey, sampling and PFCs level testing were conducted on commercially available staple foods, poultry and livestock meat, aquatic products, vegetables, milk and dairy products, eggs, etc. The food sampling points covered all subdistricts in Xuhui District, including farmers' markets, supermarkets, convenience stores, and shops. Daily exposure level and hazard ratio (HR) of PFCs per capita were calculated according to the dietary survey and laboratory testing. Logistic regression was used to estimate the relationship between PFCs exposure and the risks of adverse events during pregnancy and postpartum depression. The levels of PFCs exposure were further divided into 4 groups according to interquartile range, and OR and
P trend value were calculated respectively.ResultsA total of 345 pregnant women were recruited in this study, whose average age was (29.61±4.92) years. Among them, 26.37% subjects reported at least one adverse event during pregnancy, and 30.14% subjects reported an Edinburgh Postnatal Depression Scale (EPDS) score ≥12. A total of 132 food samples were collected and tested, and PFCs were positive mainly in milk and dairy products, poultry meat, livestock meat, eggs, fresh water products, and sea water products. The PFCs positive rate in fresh water products was the highest, reaching 100%. The average concentration of PFCs in the positive samples was 0.018-2.10 μg·kg−1. The HR of PFCs was 4.44. A higher risk of postpartum depression was found along with a higher perfluorooctane sulfonate (PFOS) exposure level (
P trend=0.02).ConclusionDietary PFCs exposure may pose a health risk to pregnant women. The study findings suggest that decreasing the intake of freshwater products might help reduce the risk of PFCs exposure among pregnant women in Xuhui district, Shanghai.
-
全氟化合物(perfluorinated compounds, PFCs)是一类人工合成的脂肪烃类化合物,通常含有一个疏水的烷基链和一个亲水的功能基团,烷基链一般由4~18个全氟化的碳链构成。该类化合物的优良化学结构使其被广泛应用于多个领域,但也正是这种稳定的结构,使其具有更持久的污染性、生物积累性、难降解性等特点。PFCs主要包括全氟羧酸类、全氟磺酸类等,其中全氟辛酸(perfluorooctanoic acid, PFOA)和全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)是目前应用最广泛并最受关注的两种全氟有机物[1]。
PFCs暴露广泛,全球人体血液样本中均可以检出[2-4]。但目前全球对PFCs的参考摄入量并没有统一的标准值,美国毒物和疾病登记署(Agency for Toxic Substances and Disease Registry, ATSDR)给出的PFOS和PFOA的每日暴露量(estimated daily intake, EDI)参考值分别为20×10−4 μg·(kg·d)−1和30×10−4 μg·(kg·d)−1[5];2020年9月欧洲食品安全局(European Food Safety Authority, EFSA)给出4种PFCs,包括PFOA、PFOS、全氟壬烷羧酸(perfluorononanoic acid , PFNA)和全氟己烷磺酸(perfluorohexane sulfonic acid, PFHxS)的合计周允许摄入量(tolerable weekly intake, TWI)参考值为44×10−4 μg·(kg·d)−1[6]。Fromme等[7]综合了潜在的PFCs摄入途径,使用模型计算得出成年人平均和最高日常摄入PFOS的量分别为1.6和8.8 ng·kg−1,PFOA为2.9和12.6 ng·kg−1。但是不同地区人群摄入PFCs的途径和能力都不尽相同,因此对PFCs暴露应该有针对性的探究。
多项研究表明,PFCs具有肝毒性、生殖毒性、发育毒性、免疫毒性和内分泌干扰作用[8-10]。人体PFCs暴露主要有3种途径:膳食摄入、皮肤接触和呼吸。在膳食摄入方面,母乳、牛奶、果蔬、禽畜肉和海水产品等食物均检出了不同水平的PFCs;衣物、家具PFCs的挥发等是皮肤暴露的主要来源;空气和灰尘则是呼吸摄入PFCs的主要来源。膳食摄入是人类PFCs暴露的重要途径[11]。并且膳食PFCs暴露可以采用调整膳食结构的方式来降低暴露量,对减少总的PFCs暴露量具有较为实际的指导意义。
孕期是一个特殊且重要的时期,国内外也展开了多项关于妊娠期母体PFCs暴露水平与子代发育关系的研究[12-14],但是针对PFCs暴露与孕期不良事件及产后抑郁的研究较少。因此本研究拟通过对上海市徐汇区孕妇进行膳食调查,了解该人群的实际膳食情况,并对其食用量较大的市售不同种类食物(主要包括大米、畜肉及禽肉类、水产品、蔬菜、蛋和乳制品等)进行主要PFCs污染物水平的检测,从膳食途径评估PFCs暴露,探索膳食PFCs暴露与孕期不良事件及产后抑郁风险的关系。
1. 材料与方法
1.1 人群研究
1.1.1 研究设计及研究对象
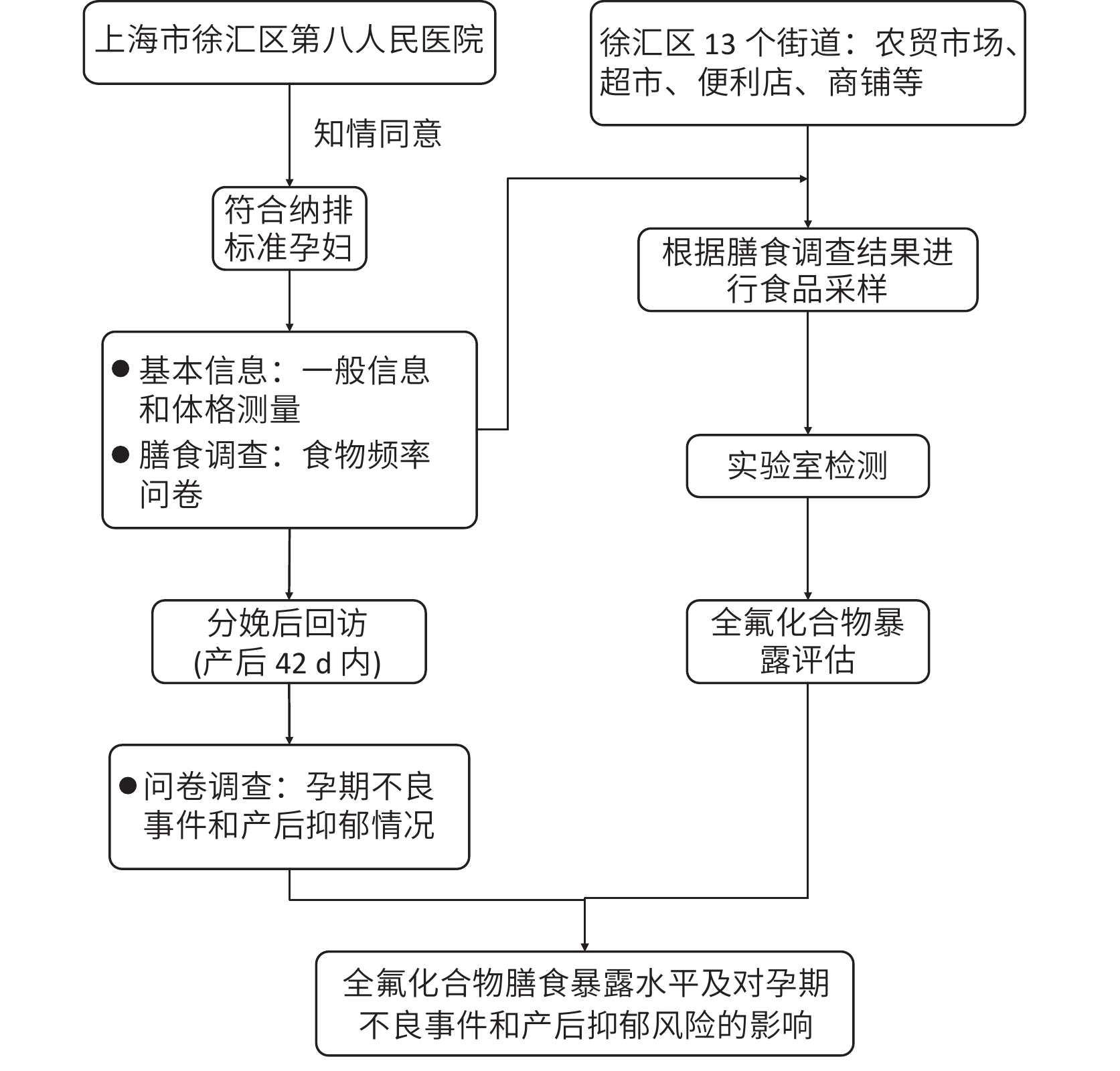
本研究是一项基于医院产检孕妇的小型前瞻性人群队列研究。根据实际情况及工作量,从2017年7月—2018年9月纳入来自上海市徐汇区第八人民医院的徐汇区常住孕期妇女约345人(户籍人口和来沪居住6个月以上人员)。排除严重精神疾病患者;有肝炎(传染期)、活动性肺结核、艾滋病等传染性疾病者;痴呆、聋哑者;卧床不起、行动不便者;及患其他影响调查进行的疾病患者。研究流程如图1所示。本研究经徐汇区疾病预防控制中心伦理委员会审批通过(批准号:20190523)。所有参与本研究的对象均已签署知情同意书。
1.1.2 信息收集
本研究采用询问调查的方式进行问卷数据收集。调查问卷的主要内容包括基本信息、膳食调查、孕期不良事件和产后抑郁情况。询问调查由培训合格的调查员以面对面的方式进行。
基本信息包括一般信息和体格测量。一般信息包括孕周、出生日期、文化程度、家庭收入、孕次和产次等;体格测量则在纳入现场进行,包括身高、体重和静息血压,血压测量3次,统计分析时取3次测量的平均值。
膳食调查通过《食物频率问卷》调查获得,收集调查对象过去3个月内各种食物消费频率及消费量,包括主食、水果、蔬菜、豆类与豆制品、乳与乳制品、菌藻类、坚果、禽肉、畜肉、禽蛋类、淡水产品和海水产品。
孕期不良事件和产后抑郁情况在纳入对象产后42 d内完成,问卷内容包括此次孕程中各种不良事件的发生情况和《爱丁堡产后抑郁自测量表》(Edinburgh Postnatal Depression Scale, EPDS)。孕期不良事件包括妊娠期糖尿病、妊娠期高血压、甲状腺异常、先兆流产、糖耐量异常、唐氏筛查阳性、畸形筛查阳性、前置胎盘、羊水过少、胎位不正和胎儿生长受限。若孕期至少发生1项上述事件,则为发生孕期不良事件,为二分类结局指标。EPDS共10个条目,每个条目以0~3分赋值,分别为0分(从未)、1分(偶尔)、2分(经常)、3分(总是)。总分为30分,得分越高,表示抑郁程度越严重。EPDS在本研究人群中的Cronbach’s α为0.883。EPDS总分在12分及以上提示可能患有不同程度的抑郁性疾病[15]。因此按照EPDS总分≥12分为界限,将其定义成二分类变量。
研究开始前,对所有调查员事先均进行全面培训,并制定标准操作流程。问卷回收时由专门的质控员对问卷的逻辑性和完整性问题进行质控,并在问卷录入过程中交叉质控10%的问卷。
1.2 食品采样与检测
1.2.1 样品采集
根据孕妇《食物频率问卷》调查结果,对孕妇日常食用量较大的市售主食类、禽畜肉类、水产品类、蔬菜类、乳与乳制品、禽蛋类等进行采样分析。为代表徐汇区市售食物PFCs含量的整体情况,采样点覆盖徐汇区所有的13个街道,包括农贸市场、超市、便利店、商铺等类型,并且每个采样点同品类样品不超过5件。
其中禽畜肉类覆盖猪肉、牛肉、羊肉等畜肉及鸡肉、鸭肉等;水产品覆盖海水产品(海水鱼、海水虾等)及淡水产品(淡水鱼、淡水虾等);蔬菜类根据其可食用部分与土壤及空气等PFCs的蓄积介质接触范围的不同,分为叶菜类(大白菜、菠菜、小白菜、韭菜等)、瓜茄类(茄子、番茄、黄瓜、冬瓜等)、块根类(白萝卜、胡萝卜、大头菜等)、块茎类(马铃薯、莲藕、茭白、竹笋等)及豆类(毛豆、刀豆、扁豆等)。样品使用聚乙烯塑封采样袋采集,采集完成后存放于装有冰袋的保温箱里,立即送往实验室完成实验前处理并检测,留样于−18 ℃条件冻存。在样品采集过程中,避免与聚四氟乙烯或其他含氟材料接触。
1.2.2 试剂及设备耗材
本研究中检测的目标PFCs包括全氟丁烷羧酸(perfluorobutanoic acid, PFBA)、全氟戊烷羧酸(perfluoropentanoic acid, PFPeA)、全氟己烷羧酸(perfluorohexanoic acid, PFHxA)、全氟庚烷羧酸(perfluoroheptanoic acid, PFHpA)、全氟辛烷羧酸、全氟壬烷羧酸、全氟辛烷磺酸和全氟癸基磺酸(perfluorodecanesulfonic acid, PFDS)。
试剂及耗材:同位素标记标准品(13C4-PFOA、13C4-PFOS)(北京振翔科技有限公司,中国)用于内标法定量分析。色谱纯度甲醇、乙腈(默克公司,德国);色谱纯度乙酸铵(上海安谱,中国);盐酸(国药集团,中国);实验用水均为自制超纯水。全氟辛酸净化柱[华谱生物科技(重庆)有限公司,中国],玻璃净化管内含100 mg 乙二胺-N-丙基硅烷化硅胶吸附剂、40 mg C18、20 mg石墨化炭黑填料。
设备:液相色谱串联质谱仪、三重四级杆串联质谱仪配电喷雾离子源(赛默飞,美国)。
1.2.3 样品前处理
前处理方法和检测方法主要参考GB 5009.253—2016《食品安全国家标准动物源性食品中全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)的测定》。匀浆后称取5 g均匀试样(精确至0.01 g)置于事先经清洗过的50 mL离心管中,加入100 ng·mL−1内标混合溶液0.02 mL,加水5 mL,涡旋混匀1 min,加10 mL乙腈和30 μL盐酸,涡旋混匀10 min。加入2 g氯化钠涡旋10 min,
4000 r·min−1(离心半径64 mm)离心10 min。取上清液于PFOA专用净化管中,涡旋2 min后取上清液于40 ℃的水浴中氮吹至干,用1 mL乙腈定容过0.22 μm有机滤膜,供液相色谱串联质谱仪测定。1.2.4 仪器条件
色谱条件:分析色谱柱,Agilent SB-Aq C18,100 mm×3.0 mm, 1.8 µm;捕集柱,Thermo Scientific Accucore C18,50 mm×2.1 mm,2.6 µm;流动相,B相为水(含5 mmol·L−1乙酸铵,A相为乙腈+甲醇1∶1;流速,0.3 mL·min−1;0.5 min A相20%,B相80%,8 min时A相90%,B相10%,8.6 min恢复到初始状态,进样量3 μL;柱温40 ℃。
质谱条件:离子源,电喷雾离子源;扫描方式,负离子扫描;检测方式,质谱多反应监测;毛细管电压,
2500 V;干燥气温度,350 ℃;离子传输管,400 ℃。1.3 质量控制与保证
实验使用的采样袋、试剂等材料均经过背景检测,避免样品采集和分析过程中受到污染。每一批次检测样品加做一个平行样、一个加标样、一个标准样、一个系统空白样和一个方法空白样。其中平行样、加标样和标准样用于监测仪器稳定性,系统空白样和方法空白样用以监测背景污染,以保证数据准确性,得到样品中的实际PFCs残留。空白组测得的PFCs浓度均低于检出限。如补充材料表S1所示,7种PFCs在0.5~10 μg·L−1线性范围良好,PFOA在0.05~1 μg·L−1线性范围良好,线性相关系数均大于0.994。8种PFCs的回收率为76.8%~118.4%,相对标准偏差范围为3.8%~13.1%。检出限由仪器三倍信噪比计算所得。
1.4 暴露估计和风险评估
根据《食物频率问卷》调查和实验室PFCs检测结果,估计PFCs的EDI和TWI。采用以下公式计算人均PFCs日暴露:EDI=(∑F·IR)/BW。其中,EDI为人体某种PFCs的每日暴露量,单位为μg·(kg·d)−1;F为食物中某种PFCs的平均含量,单位为μg·kg−1;IR为该食物的日均摄入量,单位为kg·d−1;BW为体重,单位为kg。
TWI计算公式为:TWI=7·EDI,单位为μg·(kg·周)−1。
采用危害指数(hazard ratios, HR)评估PFCs的健康风险[16],公式为:HR=EDI/RfD。其中,HR表示该PFCs的危害指数,无单位;EDI为该PFCs的日均暴露量,单位为μg·(kg·d)−1;RfD为该PFCs的参考剂量(reference dose, RfD),单位为μg·(kg·d)−1。当HR<1时,可认为该PFCs对暴露人群没有明显的健康风险;当HR≥1时,认为该PFCs对暴露人群存在健康风险。
在计算HR时选用ATSDR的EDI参考值:PFOS为20×10−4 μg·(kg·d)−1,PFOA为30×10−4 μg·(kg·d)−1;EFSA的4种PFCs(PFOA、PFNA、PFOS、PFHxS)的TWI参考值为44×10−4 μg·(kg·d)−1。
1.5 统计学分析
若PFCs浓度大于检出限(limit of detection, LOD),但小于定量限(limit of quantitation, LOQ),按照1/2LOQ计算;若检测PFCs浓度低于LOD,则按未检出统计,取值为0。
采用EpiData 3.0软件建立数据库并录入。所有数据分析及清理均使用R软件(version 4.0.1)进行。人群平均EDI采用Bootstrap方法估计(重复抽样
1000 次)。符合正态分布的连续型数据采用均值和标准差进行描述;计数数据采用频数和百分比进行描述。采用logistic回归估计PFCs暴露与孕期发生不良事件及EPDS评分≥12分的关系。分别估计单因素和多因素校正OR值及其95%CI,多因素分析时校正入组时年龄(连续变量)、入组时体重(连续变量)、孕周(连续变量)、学历(分类变量)、职业(分类变量)、孕次(二分类变量:首次、非首次)、产次(二分类变量:0次、>0次)、是否患过乳腺良性疾病(二分类变量)、是否患过妇科良性疾病(二分类变量)、怀孕前是否肥胖(二分类变量)、怀孕前血糖是否异常(二分类变量)和怀孕前是否有高脂血症(二分类变量)。并根据四分位数将PFCs分成4组,计算OR值的趋势P值。本研究所有检验均为双侧检验,检验水准α=0.05。2. 结果
2.1 基线信息
本研究共纳入孕妇345名(表1)。纳入对象的平均年龄为(29.61±4.92)岁,平均体重指数为(23.53±3.53)kg·m−2。将近一半(51.59%,178/345)纳入对象的文化程度为高中及大专,41.73%(144/345)纳入对象的家庭年收入在15~25万元之间。其中,9(2.61%)名孕妇有吸烟史,但所有对象在孕期均没有吸烟;5.50%(19/345)的孕妇有饮酒史,孕期有0.87%(3/345)的孕妇饮酒。纳入对象中,177(51.30%)名孕妇为第一次怀孕,219(63.45%)名孕妇为初产妇。
表 1 纳入对象基本信息表(n=345)Table 1. Characteristics of the participants (n=345)基线信息 纳入对象 年龄/岁,$ \bar x $(s) 29.61(4.82) 身高/cm,$ \bar x $(s) 160.97(4.91) 纳入时体重/kg,$ \bar x $(s) 61.06(9.21) 孕前体重/kg,$ \bar x $(s) 55.06(8.97) 血压/mmHg,$ \bar x $(s) 收缩压 110.32(9.72) 舒张压 68.14(7.55) 文化程度,n(%) 初中及以下 112(32.46) 高中及大专 178(51.59) 本科及以上 55(15.94) 家庭年收入/万元,n(%) <5 11.37(9.27) 5~<15 49.27(41.74) 15~<25 48.22(41.74) ≥25 8.47(7.24) 有吸烟史,n(%) 9(2.61) 有饮酒史,n(%) 19(5.51) 孕期饮酒,n(%) 3(0.87) 孕次,n(%) 1 177(51.3) ≥2 168(48.7) 产次,n(%) 0 219(63.48) ≥1 126(36.52) 曾患乳腺疾病,n(%)a 46(13.33) 曾患妇科良性疾病,n(%)b 44(12.75) 肥胖,n(%) 8(2.32) 血糖异常,n(%)c 2(0.58) 高脂血症,n(%)d 3(0.87) [注]a:包括乳腺纤维腺瘤、乳腺囊肿、乳腺小叶增生、结节、导管乳头状瘤、导管扩张症等其他乳腺疾病。b:包括子宫肌瘤、卵巢囊肿、功能失调性子宫出血、多囊卵巢综合征、痛经等其他妇科疾病。c:包括I型糖尿病、II型糖尿病、糖耐量减低、空腹血糖受损。d:包括高胆固醇血症、高甘油三酯血症、混合型高脂血症和低密度脂蛋白胆固醇血症。 本次研究中,9.57%的研究对象在本次怀孕中发生妊娠糖尿病,26.37%的研究对象至少发生过一项孕期并发症(包括妊娠期糖尿病、妊娠期高血压、甲状腺异常、先兆流产、糖耐量异常、唐氏筛查阳性、畸形筛查阳性、前置胎盘、羊水过少、胎位不正和胎儿生长受限);将近1/3(30.14%)的对象EPDS得分≥12分(表2)。
表 2 纳入对象孕期及产后不良事件的发生情况(n=345)Table 2. Adverse outcomes during pregnancy and after delivery of the participants (n=345)不良事件 n(%) 妊娠期并发症 妊娠期糖尿病 33(9.57) 妊娠期高血压 14(4.06) 甲状腺异常 26(7.54) 先兆流产 24(6.96) 糖耐量异常 22(6.38) 唐氏筛查阳性 2(0.58) 畸形筛查阳性 2(0.58) 前置胎盘 11(3.19) 羊水过少 6(1.74) 胎位不正 8(2.32) 胎儿生长受限 4(1.16) 至少发生一项 91(26.37) 不良妊娠结局 EPDS问卷评分≥12分 104(30.14) 产后出血 3(0.87) 产褥期感染 1(0.29) 切口愈合感染 275(79.71) 产后尿潴留 3(0.87) 2.2 食物中PFCs的检出和每日平均摄入情况
本研究共采集样品132件,分为12类,包括主食(n=4)、水果(n=12)、蔬菜(n=26)、豆类与豆制品(n=14)、乳与乳制品(n=10)、菌藻类(n=6)、坚果(n=8)、禽肉(n=4)、畜肉(n=11)、禽蛋类(n=10)、淡水产品(n=7)、海水产品(n=20)。本研究中,孕妇禽、畜肉类的每日平均摄入量分别为0.04 kg和0.11 kg;淡水产品和海水产品的每日平均摄入量,均为0.06 kg。PFDS、PFHpA、PFHxA和PFPeA均未检出。被检出的PFCs种类为PFNA、PFBA、PFOA和PFOS,主要分布在乳与乳制品、禽肉、畜肉、禽蛋、淡水产品和海水产品中。其中,淡水产品PFCs检出率最高,达到100%;主食、水果、蔬菜、豆类与豆制品、菌藻类和坚果均未检出PFCs。在检出PFCs的食品中,平均质量分数(后简称为浓度)在0.02~2.10 μg·kg−1之间(表3)。
表 3 徐汇区市售不同食物中PFCs的检出率、平均检出浓度及每日平均食物摄入量Table 3. The positive rates and average concentrations of PFCs and the daily dietary intake by food groups from Xuhui markets食物种类 PFCs检出
率/%*PFBA/
(μg·kg−1)PFNA/
(μg·kg−1)PFOA/
(μg·kg−1)PFOS/
(μg·kg−1)食物平均摄
入量/(kg·d−1)主食(n=4) 0.00 — — — — 0.40 水果(n=12) 0.00 — — — — 0.27 蔬菜(n=26) 0.00 — — — — 0.25 豆类与豆制品(n=14) 0.00 — — — — 0.10 乳与乳制品(n=10) 10.00 0.28 — — — 0.16 菌藻类(n=6) 0.00 — — — — 0.03 坚果(n=8) 0.00 — — — — 0.04 禽肉(n=4) 75.00 — — 0.14 — 0.04 畜肉(n=11) 18.20 — — 0.18 — 0.11 禽蛋类(n=10) 60.00 — — 0.11 0.02 0.06 淡水产品(n=7) 100.00 — 0.06 0.16 2.10 0.06 海水产品(n=20) 90.00 — 0.11 0.31 0.81 0.06 [注]*:检出任意PFCs。 2.3 PFCs食物暴露估计
经计算,PFOS的EDI值最高,平均达到(19.11±18.78)×10−4 μg·(kg·d)−1;PFBA的EDI值最低,平均为(1.18±1.17)×10−4 μg·(kg·d)−1(表4)。
表 4 孕妇膳食摄入PFCs每日暴露量和周允许摄入量Table 4. EDI and TWI of PFCs estimated by dietary intake of pregnant womenPFCs EDI/[10−4 μg·(kg·d)−1] TWI/[10−4 μg·(kg·周)−1] $ \bar x $(s) M(Q1,Q3) $ \bar x $(s) M(Q1,Q3) PFNA 9.81(8.44) 9.27(5.21,9.27) 68.67(59.09) 64.91(36.47,64.91) PFBA 1.18(1.17) 0.78(0.40,0.78) 8.25(8.20) 5.45(2.78,5.45) PFOA 7.59(5.14) 6.32(4.01,6.32) 53.14(35.95) 44.27(28.05,44.27) PFOS 19.11(18.78) 13.24(7.56,13.24) 133.76(131.43) 92.68(52.90,92.68) 使用Bootstrap法估计人群PFOS、PFOA的EDI和PFCs的TWI的均值,分别为19.07×10−4 μg·(kg·d)−1、7.57×10−4 μg·(kg·d)−1和19.49×10−4 μg·(kg·周)−1。参照ATSDR和EFSA给出的标准计算得,ATSDR:HRPFOS=0.96,HRPFOA=0.025;EFSA:HRPFCs=4.44。
2.4 PFCs膳食暴露与孕期及产后不良事件的关系
如表5所示,PFNA、PFBA、PFOA和PFOS与孕期不良事件和产后抑郁风险的关系,虽然在单因素和多因素logistic回归模型中的OR值均未发现统计学差异,但是其校正的OR点估计均大于1。在产后抑郁风险与PFOS膳食暴露的模型中,单因素和多因素的趋势OR值检验均有统计学意义(P趋势=0.02)。
表 5 孕妇PFCs膳食暴露与孕期不良事件和产后抑郁风险的关系Table 5. Associations between PFCs exposure and adverse outcomes during pregnancy and after deliveryPFCs* 至少一项孕期不良事件a EPDS≥12分 OR 95%CI AORb 95%CI OR 95%CI AORb 95%CI 上限 下限 上限 下限 上限 下限 上限 下限 PFBA Q1,<0.035 μg·kg−1 1.00 — — 1.00 — — 1.00 — — 1.00 — — Q2,0.035~<0.053 μg·kg−1 1.15 0.58 2.29 1.00 0.97 1.04 0.95 0.49 1.79 1.02 0.99 1.05 Q3,0.053~<0.071 μg·kg−1 1.65 0.86 3.17 1.54 0.70 3.40 1.24 0.67 2.30 0.87 0.42 1.76 Q4,≥0.071 μg·kg−1 1.03 0.52 2.03 1.80 0.86 3.81 0.69 0.36 1.32 1.13 0.58 2.20 P趋势 0.63 — — 0.66 — — 0.63 — — 0.66 — — 每变化1 μg·kg−1 0.86 0.00 142.86 1.01 0.94 1.08 0.86 0.00 142.86 1.01 0.94 1.08 PFNA Q1,< 0.0022 μg·kg−11.00 — — 1.00 — — 1.00 — — 1.00 — — Q2, 0.0022 ~<0.0052 μg·kg−10.90 0.45 1.78 1.00 0.96 1.03 1.15 0.58 2.29 1.02 0.99 1.06 Q3, 0.0052 ~<0.0092 μg·kg−11.02 0.52 2.00 0.60 0.26 1.36 1.68 0.87 3.29 1.13 0.52 2.50 Q4,≥ 0.0092 μg·kg−11.08 0.55 2.11 0.57 0.25 1.27 1.68 0.87 3.29 2.05 0.98 4.39 P趋势 0.75 — — 0.53 — — 0.07 — — 0.13 — — 每变化1 μg·kg−1 0.00 0.00 1073421770.02 1.01 0.95 1.08 1.21 0.99 1.50 1.03 0.97 1.10 PFOA Q1,<0.047 μg·kg−1 1.00 — — 1.00 — — 1.00 — — 1.00 — — Q2,0.047~<0.079 μg·kg−1 2.09 1.06 4.26 1.00 0.97 1.04 1.44 0.74 2.83 1.02 0.99 1.05 Q3,0.079~<0.140 μg·kg−1 1.33 0.65 2.77 1.75 0.78 4.01 1.36 0.70 2.69 1.77 0.83 3.86 Q4,≥0.140 μg·kg−1 1.59 0.79 3.28 0.84 0.37 1.93 1.68 0.87 3.29 1.45 0.69 3.10 P趋势 0.45 — — 0.92 — — 0.16 — — 0.33 — — 每变化1 μg·kg−1 2.80 0.00 5166.27 1.01 0.94 1.07 1.16 0.94 1.43 1.04 0.98 1.10 PFOS Q1,<0.046 μg·kg−1 1.00 — — 1.00 — — 1.00 — — 1.00 — — Q2,0.046~<0.079 μg·kg−1 2.08 1.02 4.36 1.01 0.97 1.04 1.39 0.69 2.80 1.02 0.99 1.05 Q3,0.079~<0.14 μg·kg−1 1.60 0.77 3.39 2.66 1.15 6.40 1.85 0.95 3.67 1.27 0.59 2.80 Q4,≥0.14 μg·kg−1 2.40 1.19 5.02 1.56 0.66 3.79 2.09 1.07 4.16 2.13 1.02 4.56 P趋势 0.04 — — 0.09 — — 0.02 — — 0.02 — — 每变化1 μg·kg−1 4.56 0.63 31.31 1.01 0.94 1.07 1.28 1.04 1.58 1.04 0.98 1.10 [注]a:至少一项孕期不良事件指孕期至少发生以下一项事件,包括妊娠期糖尿病、妊娠期高血压、甲状腺异常、先兆流产、糖耐量异常、唐氏筛查阳性、畸形筛查阳性、前置胎盘、羊水过少、胎位不正和胎儿生长受限。b:AOR为校正的OR,调整因素包括入组时年龄、入组时体重、孕周、学历、职业、孕次、产次,是否患过乳腺良性疾病、是否患过妇科良性疾病、怀孕前是否肥胖、怀孕前血糖是否异常和怀孕前是否有高脂血症。*:Q1、Q2、Q3、Q4分别代表其百分位数<25%、25%~<50%、50%~<75%、≥75%。 3. 讨论
本研究共纳入孕期妇女345名。其中,26.37%的研究对象至少发生过一项孕期不良事件;30.14%的研究对象可能患有不同程度的产后抑郁性疾病。计算得PFCs的HR为4.44,提示该4种PFCs的累积暴露对暴露人群存在健康风险。同时在产后抑郁风险与PFOS暴露的模型中观察到OR值变大的趋势,即随着PFOS暴露量增高,EPDS得分增高,暴露人群患产后抑郁的风险也增高。
在本研究中,PFCs主要在乳与乳制品、禽畜肉和水产品中检出,而在主食、水果、蔬菜、豆类与豆制品、菌藻类和坚果中均未检出。这可能与生物富集和水生生物的生物浓缩作用有关。多项国内研究也表明,在植物性食物中检出PFCs的浓度远低于动物性食物[17-19]。与近期一项北京的研究类似(奶类:∑PFCs=0.3 μg·kg−1)[20],本研究的乳与乳制品样本中只检出了PFBA且浓度为0.28 μg·kg−1。水产品中检出的PFCs包括PFNA、PFOA和PFOS,浓度为0.06~2.10 μg·kg−1,与国内外其他研究基本一致[21-24]。在禽畜肉中则只检出PFOA,禽肉中PFOA浓度为0.14 μg·kg−1,畜肉中为0.18 μg·kg−1。其中,禽肉中PFOA浓度低于中国四川[25]、山东[26]、北京[20]和意大利[27]的研究,高于挪威[18]和希腊[28];而畜肉中PFOA则高于先前所有研究。国内一项研究也表明,肉类是造成PFOA膳食暴露的主要因素,占总摄入量的93.2%[29]。
此次研究观察到了PFOS暴露与产后抑郁风险的OR值变大的趋势。海水产品是人体摄入PFOS的主要膳食来源,占总摄入量的78.9%[29],但现阶段国内外尚未有研究系统性分析膳食中PFOS暴露与发生产后抑郁的关系。产后抑郁具体病因未知,且具有众多危险因素,甲状腺功能障碍[30]、游离甲状腺素水平下降[31],甲状腺过氧化物酶抗体阳性[32],均能显著增加对象罹患产后抑郁的风险。而全氟烷酸化合物能够与凝血酶受体结合,并将其激活,从而干扰甲状腺功能。国内外研究均提示,PFOS是人群内暴露(血液含量)最高的PFCs:国外的一项研究检测了来自美国、韩国和比利时等国家9个城市的473份人体血液标本,结果显示PFOS是血液中含量最高的PFCs,PFOA次之[33];对我国9个城市85份血清样本进行分析的研究提示,虽然城市样品中的PFCs含量之间存在差异,但其中最主要的暴露也为PFOS[34]。相比于其他PFCs,PFOS的每日暴露量在本研究中也同样为最高,这也许解释了为什么可以观察到OR值变大的趋势。同时,参照EFSA的标准,HRPFCs为4.44,提示其暴露对该类人群存在健康风险。
充分摄入蔬菜、水果、豆类、海水产品、牛奶和奶制品、橄榄油和各种营养品可降低罹患产后抑郁症风险[35]。来自23个国家的一项生态研究发现,增加海水产品消费可以降低产后抑郁症风险,这可能是与摄入富含二十二碳六烯酸的深海鱼有关[36-37]。在微量营养素中,锌和硒可以减少产后抑郁症的发生率[38]。锌可能通过影响血清素的再吸收来发挥抗抑郁作用,硒可能通过影响甲状腺功能来影响产后抑郁的发生[39]。锌和硒都可以从红肉、谷物、肉类和鱼类中摄取。本研究中,主食、水果、蔬菜、豆类与豆制品、菌藻类和坚果均未检出PFCs,乳与乳制品也只检出了PFBA,且每日暴露量也为4种检出PFCs中最低,乳与乳制品可能对发生产后不良事件和产后抑郁风险具有保护作用[35]。本研究中,PFOS只在水产品和禽蛋类中检出,且淡水产品中PFOS含量最高。同时根据《食物频率问卷》调查结果显示,纳入对象鱼、禽、肉、蛋类食物的每日平均摄入总量约为0.33 kg,远高于《2022中国居民膳食指南》中的推荐量,蔬菜(0.25 kg)和乳与乳制品(0.16 kg)摄入不足,膳食结构仍有优化的空间。基于以上分析,提示孕期妇女可以适量减少淡水产品的摄入,以此降低PFCs的暴露风险。
本研究有以下局限性:所有研究对象及采样食品均来自上海徐汇区,内部一致性较好,但是外推性较为局限;本研究使用的临床结局均来问卷调查,虽然控制在产后42 d内完成,最大程度上避免了回忆偏倚,同时在数据录入过程中采用质量控制手段,但是相比于直接从医院信息系统调取的电子记录,仍可能出错;本研究采用EPDS自测量表来评估研究对象患产后抑郁的风险,若使用临床诊断,可以使结果更加明了;尽管本研究调整了一系列可能影响研究结局的混杂因素,但可能仍存在尚未被观察到的潜在混杂因素没有被纳入调整;由于现场操作难度较高,及纳入对象依从性问题,难以收集到血液等生物样本,缺乏PFCs的内暴露数据,无法评估膳食PFCs暴露水平和人体内PFCs水平的关系;本研究只在纳入对象时进行一次《食物频率问卷》的获取,没有覆盖整个孕期中的膳食结构的具体变化,只能做一个平均的近似估计,可能会影响本研究暴露估计;本研究只关注了膳食中PFCs的暴露情况,尚未对调味品(如,油盐酱醋)和饮用水进行PFCs含量的测量,可能低估了人群真正的PFCs膳食暴露水平;由于PFOS的限制生产和使用,氯代多氟烷基醚磺酸盐(F-53B)作为PFOS的替代品近年来工业用量增幅明显,但本研究中未涉及相关检测,希望在后续的研究中能加以重视。
综上所述,本研究通过前瞻性队列研究,保守估计了徐汇区孕期妇女膳食中PFCs的暴露情况,结果仍显示HRPFCs达到4.44,远大于1,提示该人群存在健康风险。同时依据食物PFCs检出结果,提示该人群可以适当调整饮食结构,减少淡水产品的摄入(PFCs检出率及检出浓度最高),以降低PFCs的膳食暴露风险。虽然本研究提示了PFCs的膳食暴露对孕期妇女发生不良孕期事件及发生产后抑郁的风险可能为危险因素,但是,由于目标人群PFCs膳食暴露量较低,需要对该结果谨慎解读,同时需要更大的样本量来验证该结果。
-
表 1 纳入对象基本信息表(n=345)
Table 1 Characteristics of the participants (n=345)
基线信息 纳入对象 年龄/岁,$ \bar x $(s) 29.61(4.82) 身高/cm,$ \bar x $(s) 160.97(4.91) 纳入时体重/kg,$ \bar x $(s) 61.06(9.21) 孕前体重/kg,$ \bar x $(s) 55.06(8.97) 血压/mmHg,$ \bar x $(s) 收缩压 110.32(9.72) 舒张压 68.14(7.55) 文化程度,n(%) 初中及以下 112(32.46) 高中及大专 178(51.59) 本科及以上 55(15.94) 家庭年收入/万元,n(%) <5 11.37(9.27) 5~<15 49.27(41.74) 15~<25 48.22(41.74) ≥25 8.47(7.24) 有吸烟史,n(%) 9(2.61) 有饮酒史,n(%) 19(5.51) 孕期饮酒,n(%) 3(0.87) 孕次,n(%) 1 177(51.3) ≥2 168(48.7) 产次,n(%) 0 219(63.48) ≥1 126(36.52) 曾患乳腺疾病,n(%)a 46(13.33) 曾患妇科良性疾病,n(%)b 44(12.75) 肥胖,n(%) 8(2.32) 血糖异常,n(%)c 2(0.58) 高脂血症,n(%)d 3(0.87) [注]a:包括乳腺纤维腺瘤、乳腺囊肿、乳腺小叶增生、结节、导管乳头状瘤、导管扩张症等其他乳腺疾病。b:包括子宫肌瘤、卵巢囊肿、功能失调性子宫出血、多囊卵巢综合征、痛经等其他妇科疾病。c:包括I型糖尿病、II型糖尿病、糖耐量减低、空腹血糖受损。d:包括高胆固醇血症、高甘油三酯血症、混合型高脂血症和低密度脂蛋白胆固醇血症。 表 2 纳入对象孕期及产后不良事件的发生情况(n=345)
Table 2 Adverse outcomes during pregnancy and after delivery of the participants (n=345)
不良事件 n(%) 妊娠期并发症 妊娠期糖尿病 33(9.57) 妊娠期高血压 14(4.06) 甲状腺异常 26(7.54) 先兆流产 24(6.96) 糖耐量异常 22(6.38) 唐氏筛查阳性 2(0.58) 畸形筛查阳性 2(0.58) 前置胎盘 11(3.19) 羊水过少 6(1.74) 胎位不正 8(2.32) 胎儿生长受限 4(1.16) 至少发生一项 91(26.37) 不良妊娠结局 EPDS问卷评分≥12分 104(30.14) 产后出血 3(0.87) 产褥期感染 1(0.29) 切口愈合感染 275(79.71) 产后尿潴留 3(0.87) 表 3 徐汇区市售不同食物中PFCs的检出率、平均检出浓度及每日平均食物摄入量
Table 3 The positive rates and average concentrations of PFCs and the daily dietary intake by food groups from Xuhui markets
食物种类 PFCs检出
率/%*PFBA/
(μg·kg−1)PFNA/
(μg·kg−1)PFOA/
(μg·kg−1)PFOS/
(μg·kg−1)食物平均摄
入量/(kg·d−1)主食(n=4) 0.00 — — — — 0.40 水果(n=12) 0.00 — — — — 0.27 蔬菜(n=26) 0.00 — — — — 0.25 豆类与豆制品(n=14) 0.00 — — — — 0.10 乳与乳制品(n=10) 10.00 0.28 — — — 0.16 菌藻类(n=6) 0.00 — — — — 0.03 坚果(n=8) 0.00 — — — — 0.04 禽肉(n=4) 75.00 — — 0.14 — 0.04 畜肉(n=11) 18.20 — — 0.18 — 0.11 禽蛋类(n=10) 60.00 — — 0.11 0.02 0.06 淡水产品(n=7) 100.00 — 0.06 0.16 2.10 0.06 海水产品(n=20) 90.00 — 0.11 0.31 0.81 0.06 [注]*:检出任意PFCs。 表 4 孕妇膳食摄入PFCs每日暴露量和周允许摄入量
Table 4 EDI and TWI of PFCs estimated by dietary intake of pregnant women
PFCs EDI/[10−4 μg·(kg·d)−1] TWI/[10−4 μg·(kg·周)−1] $ \bar x $(s) M(Q1,Q3) $ \bar x $(s) M(Q1,Q3) PFNA 9.81(8.44) 9.27(5.21,9.27) 68.67(59.09) 64.91(36.47,64.91) PFBA 1.18(1.17) 0.78(0.40,0.78) 8.25(8.20) 5.45(2.78,5.45) PFOA 7.59(5.14) 6.32(4.01,6.32) 53.14(35.95) 44.27(28.05,44.27) PFOS 19.11(18.78) 13.24(7.56,13.24) 133.76(131.43) 92.68(52.90,92.68) 表 5 孕妇PFCs膳食暴露与孕期不良事件和产后抑郁风险的关系
Table 5 Associations between PFCs exposure and adverse outcomes during pregnancy and after delivery
PFCs* 至少一项孕期不良事件a EPDS≥12分 OR 95%CI AORb 95%CI OR 95%CI AORb 95%CI 上限 下限 上限 下限 上限 下限 上限 下限 PFBA Q1,<0.035 μg·kg−1 1.00 — — 1.00 — — 1.00 — — 1.00 — — Q2,0.035~<0.053 μg·kg−1 1.15 0.58 2.29 1.00 0.97 1.04 0.95 0.49 1.79 1.02 0.99 1.05 Q3,0.053~<0.071 μg·kg−1 1.65 0.86 3.17 1.54 0.70 3.40 1.24 0.67 2.30 0.87 0.42 1.76 Q4,≥0.071 μg·kg−1 1.03 0.52 2.03 1.80 0.86 3.81 0.69 0.36 1.32 1.13 0.58 2.20 P趋势 0.63 — — 0.66 — — 0.63 — — 0.66 — — 每变化1 μg·kg−1 0.86 0.00 142.86 1.01 0.94 1.08 0.86 0.00 142.86 1.01 0.94 1.08 PFNA Q1,< 0.0022 μg·kg−11.00 — — 1.00 — — 1.00 — — 1.00 — — Q2, 0.0022 ~<0.0052 μg·kg−10.90 0.45 1.78 1.00 0.96 1.03 1.15 0.58 2.29 1.02 0.99 1.06 Q3, 0.0052 ~<0.0092 μg·kg−11.02 0.52 2.00 0.60 0.26 1.36 1.68 0.87 3.29 1.13 0.52 2.50 Q4,≥ 0.0092 μg·kg−11.08 0.55 2.11 0.57 0.25 1.27 1.68 0.87 3.29 2.05 0.98 4.39 P趋势 0.75 — — 0.53 — — 0.07 — — 0.13 — — 每变化1 μg·kg−1 0.00 0.00 1073421770.02 1.01 0.95 1.08 1.21 0.99 1.50 1.03 0.97 1.10 PFOA Q1,<0.047 μg·kg−1 1.00 — — 1.00 — — 1.00 — — 1.00 — — Q2,0.047~<0.079 μg·kg−1 2.09 1.06 4.26 1.00 0.97 1.04 1.44 0.74 2.83 1.02 0.99 1.05 Q3,0.079~<0.140 μg·kg−1 1.33 0.65 2.77 1.75 0.78 4.01 1.36 0.70 2.69 1.77 0.83 3.86 Q4,≥0.140 μg·kg−1 1.59 0.79 3.28 0.84 0.37 1.93 1.68 0.87 3.29 1.45 0.69 3.10 P趋势 0.45 — — 0.92 — — 0.16 — — 0.33 — — 每变化1 μg·kg−1 2.80 0.00 5166.27 1.01 0.94 1.07 1.16 0.94 1.43 1.04 0.98 1.10 PFOS Q1,<0.046 μg·kg−1 1.00 — — 1.00 — — 1.00 — — 1.00 — — Q2,0.046~<0.079 μg·kg−1 2.08 1.02 4.36 1.01 0.97 1.04 1.39 0.69 2.80 1.02 0.99 1.05 Q3,0.079~<0.14 μg·kg−1 1.60 0.77 3.39 2.66 1.15 6.40 1.85 0.95 3.67 1.27 0.59 2.80 Q4,≥0.14 μg·kg−1 2.40 1.19 5.02 1.56 0.66 3.79 2.09 1.07 4.16 2.13 1.02 4.56 P趋势 0.04 — — 0.09 — — 0.02 — — 0.02 — — 每变化1 μg·kg−1 4.56 0.63 31.31 1.01 0.94 1.07 1.28 1.04 1.58 1.04 0.98 1.10 [注]a:至少一项孕期不良事件指孕期至少发生以下一项事件,包括妊娠期糖尿病、妊娠期高血压、甲状腺异常、先兆流产、糖耐量异常、唐氏筛查阳性、畸形筛查阳性、前置胎盘、羊水过少、胎位不正和胎儿生长受限。b:AOR为校正的OR,调整因素包括入组时年龄、入组时体重、孕周、学历、职业、孕次、产次,是否患过乳腺良性疾病、是否患过妇科良性疾病、怀孕前是否肥胖、怀孕前血糖是否异常和怀孕前是否有高脂血症。*:Q1、Q2、Q3、Q4分别代表其百分位数<25%、25%~<50%、50%~<75%、≥75%。 -
[1] 张恣意, 龚艳, 曹文成, 等. 我国主要食品中全氟烷基化合物的污染现状及膳食暴露评估研究进展[J]. 食品工业科技, 2021, 42(8): 410-416. doi: 10.13386/j.issn1002-0306.2020100157 ZHANG Z Y, GONG Y, CAO W Z, et al. Research progress of concentrations and exposure assessment of perfluorinated alkyl substances in main food in China[J]. Sci Technol Food Ind, 2021, 42(8): 410-416. doi: 10.13386/j.issn1002-0306.2020100157
[2] 曹培, 付寒鸣, 黄宏, 等. 不同职业人群血清PFOS和PFOA负荷水平检测[J]. 中国公共卫生, 2010, 26(8): 1015-1016. doi: 10.11847/zgggws2010-26-08-40 CAO P, FU H M, HUANG H, et al. Serum concentration of perfluorooctane sulfonate acid (PFOS) and perfluorooctanoic acid (PFOA)among workers in Wenzhou[J]. Chin J Public Health, 2010, 26(8): 1015-1016. doi: 10.11847/zgggws2010-26-08-40
[3] KATO K, WONG L Y, JIA L T, et al. Trends in exposure to polyfluoroalkyl chemicals in the U. S. population: 1999-2008[J]. Environ Sci Technol, 2011, 45(19): 8037-8045. doi: 10.1021/es1043613
[4] KANNAN K, CORSOLINI S, FALANDYSZ J, et al. Perfluorooctanesulfonate and related fluorochemicals in human blood from several countries[J]. Environ Sci Technol, 2004, 38(17): 4489-4495. doi: 10.1021/es0493446
[5] LI X, DONG S, ZHANG W, et al. The occurrence of perfluoroalkyl acids in an important feed material (fishmeal) and its potential risk through the farm-to-fork pathway to humans[J]. J Hazard Mater, 2019, 367: 559-567. doi: 10.1016/j.jhazmat.2018.12.103
[6] EFSA Panel on Contaminants in the Food Chain (EFSA CONTAM Panel), SCHRENK D, BIGNAMI M, et al. Risk to human health related to the presence of perfluoroalkyl substances in food[J]. EFSA J, 2020, 18(9): e06223.
[7] FROMME H, TITTLEMIER S A, VÖLKEL W, et al. Perfluorinated compounds—Exposure assessment for the general population in western countries[J]. Int J Hyg Environ Health, 2009, 212(3): 239-270. doi: 10.1016/j.ijheh.2008.04.007
[8] GIESY J P, KANNAN K. Peer reviewed: perfluorochemical surfactants in the environment[J]. Environ Sci Technol, 2002, 36(7): 146A-152A. doi: 10.1021/es022253t
[9] KENNEDY G L, BUTENHOFF J L, OLSEN G W, et al. The toxicology of perfluorooctanoate[J]. Crit Rev Toxicol, 2004, 34(4): 351-384. doi: 10.1080/10408440490464705
[10] RENNER R. Evidence of toxic effects and environmental impacts has sent researchers scrambling to obtain more data[J]. Environ Sci Technol:ES& T, 2001, 35(7): 154A-160A.
[11] The Committee on Toxicity of Chemicals in Food, Consumer Products and the Environment (COT). Statement on the EFSA Opinion on the risks to human health related to the presence of perfluoroalkyl substances (PFASs) in food: Lay Summary[EB/OL]. (2022-04-22)[2022-04-22]. https://cot.food.gov.uk/Statement%20on%20the%20EFSA%20Opinion%20on%20the%20risks%20to%20human%20health%20related%20to%20the%20presence%20of%20perfluoroalkyl%20substances%20(PFASs)%20in%20food:%20Lay%20Summary.
[12] MAISONET M, TERRELL M L, MCGEEHIN M A, et al. Maternal concentrations of polyfluoroalkyl compounds during pregnancy and fetal and postnatal growth in British girls[J]. Environ Health Perspect, 2012, 120(10): 1432-1437. doi: 10.1289/ehp.1003096
[13] BACH C C, BECH B H, NOHR E A, et al. Perfluoroalkyl acids in maternal serum and indices of fetal growth: the Aarhus birth cohort[J]. Environ Health Perspect, 2016, 124(6): 848-854. doi: 10.1289/ehp.1510046
[14] KWON E J, SHIN J S, KIM B M, et al. Prenatal exposure to perfluorinated compounds affects birth weight through GSTM1 polymorphism[J]. J Occup Environ Med, 2016, 58(6): e198-e205. doi: 10.1097/JOM.0000000000000739
[15] 郭秀静, 王玉琼, 陈静. 爱丁堡产后抑郁量表在成都地区产妇中应用的效能研究[J]. 中国实用护理杂志, 2009, 25(1): 4-6. GUO X J, WANG Y Q, CHEN J. Study on the efficacy of the Edinburgh postnatal depression scale in puerperas in Chengdu[J] Chin J Pract Nurs, 2009, 25(1): 4-6.
[16] WANG Q, SONG X, WEI C, et al. Distribution, source identification and health risk assessment of PFASs in groundwater from Jiangxi Province, China[J]. Chemosphere, 2022, 291: 132946. doi: 10.1016/j.chemosphere.2021.132946
[17] SZNAJDER-KATARZYŃSKA K, SURMA M, CIEŚLIK E, et al. The perfluoroalkyl substances (PFASs) contamination of fruits and vegetables[J]. Food Addit Contam Part A, 2018, 35(9): 1776-1786. doi: 10.1080/19440049.2018.1502477
[18] HAUG L S, SALIHOVIC S, JOGSTEN I E, et al. Levels in food and beverages and daily intake of perfluorinated compounds in Norway[J]. Chemosphere, 2010, 80(10): 1137-1143. doi: 10.1016/j.chemosphere.2010.06.023
[19] 丁林玉, 雷素珍, 曾红亮. 全氟和多氟烷基化合物的危害及在食品中的污染研究进展[J]. 食品工业科技, 2020, 41(20): 336-341,350. DING L Y, LEI X Z, ZENG H L. Research progress on the harm of perfluoroalkyl and polyfluoroalkyl substances and their contamination in food[J]. Sci Technol Food Ind, 2020, 41(20): 336-341,350.
[20] 刘逸飞, 李阳, 赵楠楠, 等. 北京市售动物源性食品中全氟化合物赋存及居民摄入风险评估[J]. 环境化学, 2021, 40(11): 3360-3367. doi: 10.7524/j.issn.0254-6108.2021010603 LIU Y F, LI Y, ZHAO N N, et al. Occurrence of perfluoroalkyl substances in animal-derived food in Beijing and risk assessment of residents’ intake[J]. Environ Chem, 2021, 40(11): 3360-3367. doi: 10.7524/j.issn.0254-6108.2021010603
[21] 柳思帆, 王铁宇, 薛科社, 等. 北京水源地鱼体全氟化合物的暴露水平及其健康风险[J]. 生态毒理学报, 2017, 12(1): 111-118. LIU S F, WANG T Y, XUE K S, et al. Occurrence and human health risk of PFASs in fishes from drinking water sources of Beijing[J]. Asian J Ecotoxicol, 2017, 12(1): 111-118.
[22] 方国康, 徐建明, 李若慧, 等. 全氟化合物污染现状及其与肝型脂肪酸结合蛋白相互作用研究进展[J]. 食品科学, 2020, 41(7): 329-335. FANG G K, XU J M, LI R H, et al. Current pollution situation of perfluorinated compounds in waters and foodstuffs and recent progress in understanding their interactions with liver fatty acid binding protein[J]. Food Sci, 2020, 41(7): 329-335.
[23] NOORLANDER C W, VAN LEEUWEN S P J, TE BIESEBEEK J D, et al. Levels of perfluorinated compounds in food and dietary intake of PFOS and PFOA in the netherlands[J]. J Agric Food Chem, 2011, 59(13): 7496-7505. doi: 10.1021/jf104943p
[24] DOMINGO J L, ERICSON-JOGSTEN I, PERELLÓ G, et al. Human exposure to perfluorinated compounds in Catalonia, Spain: contribution of drinking water and fish and shellfish[J]. J Agric Food Chem, 2012, 60(17): 4408-4415. doi: 10.1021/jf300355c
[25] 白润叶, 张毅, 肖陈贵, 等. 中国部分主产区鸡肉中全氟化合物残留水平调查[J]. 食品安全质量检测学报, 2016, 7(2): 730-740. doi: 10.19812/j.cnki.jfsq11-5956/ts.2016.02.058 BAI R Y, ZHANG Y, XIAO C G, et al. Investigation of perfluorinated compounds in chicken from parts of main producing areas of China[J]. J Food Saf Quality, 2016, 7(2): 730-740. doi: 10.19812/j.cnki.jfsq11-5956/ts.2016.02.058
[26] 刘晓湾, 张鸿, 李静, 等. 中国沿海地区鸡蛋中全氟化合物污染水平及分布[J]. 食品科学, 2016, 37(4): 191-196. LIU X W, ZHANG H, LI J, et al. Investigation of contamination levels of perfluorinated compounds in eggs from nine coastal provinces of China[J]. Food Sci, 2016, 37(4): 191-196.
[27] GUERRANTI C, PERRA G, CORSOLINI S, et al. Pilot study on levels of perfluorooctane sulfonic acid (PFOS) and perfluorooctanoic acid (PFOA) in selected foodstuffs and human milk from Italy[J]. Food Chem, 2013, 140(1/2): 197-203.
[28] KEDIKOGLOU K, COSTOPOULOU D, VASSILIADOU I, et al. Preliminary assessment of general population exposure to perfluoroalkyl substances through diet in Greece[J]. Environ Res, 2019, 177: 108617. doi: 10.1016/j.envres.2019.108617
[29] ZHANG T, SUN H W, WU Q, et al. Perfluorochemicals in meat, eggs and indoor dust in China: assessment of sources and pathways of human exposure to perfluorochemicals[J]. Environ Sci Technol, 2010, 44(9): 3572-3579. doi: 10.1021/es1000159
[30] BLOCH M, DALY R C, RUBINOW D R. Endocrine factors in the etiology of postpartum depression[J]. Compr Psychiatry, 2003, 44(3): 234-246. doi: 10.1016/S0010-440X(03)00034-8
[31] PEDERSEN C A, JOHNSON J L, SILVA S, et al. Antenatal thyroid correlates of postpartum depression[J]. Psychoneuroendocrinology, 2007, 32(3): 235-245. doi: 10.1016/j.psyneuen.2006.12.010
[32] KUIJPENS J L, VADER H L, DREXHAGE H A, et al. Thyroid peroxidase antibodies during gestation are a marker for subsequent depression postpartum[J]. Eur J Endocrinol, 2001, 145(5): 579-584.
[33] YEUNG L W Y, SO M K, JIANG G B, et al. Perfluorooctanesulfonate and related fluorochemicals in human blood samples from China[J]. Environ Sci Technol, 2006, 40(3): 715-720. doi: 10.1021/es052067y
[34] CHATZI L, MELAKI V, SARRI K, et al. Dietary patterns during pregnancy and the risk of postpartum depression: the mother-child 'Rhea' cohort in Crete, Greece[J]. Public Health Nutr, 2011, 14(9): 1663-1670. doi: 10.1017/S1368980010003629
[35] HIBBELN J R. Seafood consumption, the DHA content of mothers' milk and prevalence rates of postpartum depression: a cross-national, ecological analysis[J]. J Affect Disord, 2002, 69(1/3): 15-29.
[36] GUR E B, GOKDUMAN A, TURAN G A, et al. Mid-pregnancy vitamin D levels and postpartum depression[J]. Eur J Obstet Gynecol Reprod Biol, 2014, 179: 110-116. doi: 10.1016/j.ejogrb.2014.05.017
[37] ELLSWORTH-BOWERS E R, CORWIN E J. Nutrition and the psychoneuroimmunology of postpartum depression[J]. Nutr Res Rev, 2012, 25(1): 180-192. doi: 10.1017/S0954422412000091
[38] LEVENSON C W. Zinc: the new antidepressant?[J]. Nutr Rev, 2006, 64(1): 39-42. doi: 10.1111/j.1753-4887.2006.tb00171.x
[39] SHER L. Role of thyroid hormones in the effects of selenium on mood, behavior, and cognitive function[J]. Med Hypotheses, 2001, 57(4): 480-483. doi: 10.1054/mehy.2001.1369
-
期刊类型引用(2)
1. 王梓皓,梁凤至,陈学蓉,吴萍,吴微. 基于高效液相色谱-串联质谱测定孕妇血清中7种全氟和多氟化合物及新生儿神经行为评价. 色谱. 2024(02): 194-202 .  百度学术
百度学术
2. 孙晨,王溪,杨润. 超高效液相色谱-串联质谱法测定液态乳中的19种全氟烷基化合物. 中国食品卫生杂志. 2024(12): 1325-1332 .  百度学术
百度学术
其他类型引用(1)
-
-
PDF格式
22396 补充材料 189KB
-
-
-



 下载:
下载:

